题目内容
6.A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.请回答下列问题:(1)B元素的名称是氮.
(2)C、D、E三种原子对应的离子半径由大到小的顺序是S2->O2->Na+ (填具体离子).
(3)用某废弃的太阳能电池板中的半导体材料与A、C、D组成的化合物溶液反应,该反应的离子方程式为:Si+2OH-+H2O=SiO32-+2H2↑.
(4)在100mL 18mol/L的浓的A、C、E组成的酸溶液中加入过量的铜片,加热使之充分反应,铜片部分溶解.产生的气体在标准状况下的体积可能是ab(填序号).
a.7.32L; b.6.72L c.20.16L d.30.24L
欲使上述反应中剩余的铜片继续溶解,可向其中加入B的最高价含氧酸所形成的钠盐,反应的离子方程式为:3Cu+8H++2NO3-+=3Cu2++2NO↑+4H2O.
分析 A、B、C、D、E为原子序数依次增大的五种短周期元素,B、C和E在周期表中相邻,且C、E同主族,则B、C处于第二周,E处于第三周期,A和D最外层电子数相同,二者同主族,结合原子序数可知D只能处于第三周期,B、C的最外层电子数之和等于D的原子核外电子数,B、C最外层电子数之和最大为13,D的核外电子数只能为11或13,其中仅含有一种金属元素,且A和C可形成两种常见的液态化合物,则A为H元素、B为N元素、C为O元素、D为Na、E为S元素,据此解答.
解答 解:A、B、C、D、E为原子序数依次增大的五种短周期元素,B、C和E在周期表中相邻,且C、E同主族,则B、C处于第二周,E处于第三周期,A和D最外层电子数相同,二者同主族,结合原子序数可知D只能处于第三周期,B、C的最外层电子数之和等于D的原子核外电子数,B、C最外层电子数之和最大为13,D的核外电子数只能为11或13,其中仅含有一种金属元素,且A和C可形成两种常见的液态化合物,则A为H元素、B为N元素、C为O元素、D为Na、E为S元素.
(1)由上述分析可知,B元素的名称是:氮,故答案为:氮;
(2)离子的电子层数越多,其离子半径越大,电子层结构相同的离子中,离子半径随着核电荷数的增大而减小,所以离子半径大小顺序是S2->O2->Na+,
故答案为:S2->O2->Na+;
(3)太阳能电池板中的半导体材料为Si,与A、C、D组成的化合物为NaOH,该反应的离子方程式为:Si+2OH-+H2O=SiO32-+2H2↑,
故答案为:Si+2OH-+H2O=SiO32-+2H2↑;
(4)在100mL 18mol/L的浓H2SO4溶液中加入过量的铜片,加热使之充分反应,铜片部分溶解,随反应进行浓硫酸变为稀硫酸,稀硫酸不与Cu反应,硫酸的物质的量为0.1mol/L×18mol/L=1.8mol,发生反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,假设浓硫酸完全反应,生成二氧化硫为0.9mol,故实际生成二氧化硫的体积小于0.9mol×22.4L/mol=20.16L,
欲使上述反应中剩余的铜片继续溶解,可向其中加入B的最高价含氧酸所形成的钠盐,即进入NaNO3,反应的离子方程式为:3Cu+8H++2NO3-+=3Cu2++2NO↑+4H2O,
故选:ab;3Cu+8H++2NO3-+=3Cu2++2NO↑+4H2O.
点评 本题考查位置结构性质关系及其应用,推断元素是解题关键,侧重考查学生分析推理能力、知识迁移应用能力,难度中等.

 阅读快车系列答案
阅读快车系列答案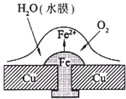 已知铅蓄电池的总反应PbO2+Pb+2H2SO4 $?_{充电}^{放电}$ 2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )
已知铅蓄电池的总反应PbO2+Pb+2H2SO4 $?_{充电}^{放电}$ 2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )| A. | 铅蓄电池放电时,电路中每转移2mol电子,生成1mol硫酸铅 | |
| B. | 如图,铁铆钉发生吸氧腐蚀,在铁钉附近滴加K3[Fe(CN)6]溶液,可观察铁钉附近有蓝色沉淀产生 | |
| C. | 铅蓄电池充电时,阳极电极反应为 PbSO4+2H2O-2e-═PbO2+4H++SO42- | |
| D. | 铅蓄电池放电时,内电路硫酸根离子向铅极移动,正极附近溶液的pH增大 |
| A. | 可用丁达尔现象区分溶液与胶体 | |
| B. | 胶体粒子直径在1 nm~100 nm之间 | |
| C. | 胶体粒子可以透过滤纸,不能透过半透膜 | |
| D. | 胶体带电荷,而溶液呈电中性 |
| A. | 乙醇和甘油互为同系物 | |
| B. | 分子式为C7H8O且分子中有苯环的有机物共有4种 | |
| C. | 苯乙烯分子中所有原子可能在同一个平面上 | |
| D. | 测定溴乙烷中的溴元素,加入NaOH溶液加热,冷却后加入AgNO3溶液后有浅黄色沉淀生成 |

| A. | 铜片表面有气泡生成 | |
| B. | 装置中存在“化学能→电能→光能”的转换 | |
| C. | 如果将锌片换成铁片,电路中的电流方向不变 | |
| D. | 如果将稀硫酸换成柠檬汁,导线中不会有电子流动 |
甲.Al$\stackrel{H_{2}SO_{4}}{→}$Al2(SO4)2$\stackrel{NaOH}{→}$Al(OH)3
乙.Al$\stackrel{NaOH}{→}$NaAlO2$\stackrel{H_{2}SO_{4}}{→}$Al(OH)3
丙.
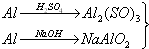 →Al(OH)3
→Al(OH)3若要制备等量的氢氧化铝,则( )
| A. | 乙消耗原料少 | B. | 三者消耗原料相同 | ||
| C. | 丙消耗原料最少 | D. | 甲、乙消耗原料相同 |
| A. | 酸性强弱:H4SiO4<H2CO3<HNO3 | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 金属性:Na<Mg<Al | D. | 熔点:金刚石>食盐>干冰 |
| A. | 食盐中氯化钠的电子式: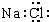 | |
| B. | 蔗糖分子与食醋中的醋酸分子的最简式相同 | |
| C. | 黄酒中乙醇的结构简式:CH3CH2OH | |
| D. | 淀粉在一定条件下水解的最终产物是蔗糖 |
| A. | 加入BaCl2溶液产生白色沉淀 | B. | 加入碘水不变蓝 | ||
| C. | 加入BaCl2溶液没有白色沉淀产生 | D. | 加入碘水变蓝 |