题目内容
11.将1.92g铜置入一定量的浓硝酸中,恰好完全反应,共收集到1.12L气体(标准状况),求:(1)上述过程中,有关反应的离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O、3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(2)反应中的HNO3的物质的量是0.11mol.
(3)将收集上述气体的容器倒扣在盛有水的水槽中,待气体体积不变后向其中缓慢通入O2,使其充分反应,若要使水恰好充满容器,理论上需要参加反应的O2的物质的量是0.015摩尔.
分析 (1)随反应进行,浓硝酸变为稀硝酸,发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(2)反应中HNO3起氧化剂、酸性作用,其氧化剂的硝酸反应得到NO2、NO,根据铜原子守恒计算Cu(NO3)2,根据N原子守恒计算反应的HNO3;
(3)收集上述气体的容器倒扣在盛有水的水槽中,二氧化氮反应反应生成硝酸与NO,剩余气体为NO,Cu原子失去电子等于生成剩余NO获得电子,待气体体积不变后向其中缓慢通入O2,又转化得到硝酸,纵观整个过程,Cu原子失去电子等于氧气获得电子.
解答 解:(1)随反应进行,浓硝酸变为稀硝酸,发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,反应离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O、3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O、3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)反应中HNO3起氧化剂、酸性作用,其氧化剂的硝酸反应得到NO2、NO,气体气体总物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,Cu的物质的量为$\frac{1.92g}{64g/mol}$=0.03mol,根据铜原子守恒n[Cu(NO3)2]=n(Cu)=0.03mol,根据N原子守恒,反应的HNO3为0.05mol+0.03mol×2=0.11mol,
故答案为:0.11;
(3)收集上述气体的容器倒扣在盛有水的水槽中,二氧化氮反应反应生成硝酸与NO,剩余气体为NO,Cu原子失去电子等于生成剩余NO获得电子,待气体体积不变后向其中缓慢通入O2,又转化得到硝酸,纵观整个过程,Cu原子失去电子等于氧气获得电子,根据电子转移守恒,可知需要氧气物质的量为$\frac{0.03mol×2}{4}$=0.015mol,
故答案为:0.015.
点评 本题考查根据方程式及氧化还原反应的有关计算,难度中等,注意根据原子守恒、电子转移守恒进行的计算,注意(3)中利用方程式进行计算,比较麻烦,为易错点、难点.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 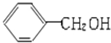 与 与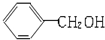 互为同系物 互为同系物 | B. | 乙醇和二甲醚互为同分异构体 | ||
| C. | 乙醇、乙二醇、丙三醇互为同系物 | D. | 可用浓溴水来区分乙醇和苯酚 |

| A. | 反应①中氧化剂与还原剂的物质的量之比为1:4 | |
| B. | 反应②属于非氧化还原反应 | |
| C. | 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1 | |
| D. | 根据反应⑤可判断还原性:Al>Mn |
| A. | 0.1mol | B. | 0.15mol | C. | 0.5mol | D. | 0.75mol |
| A. | (3)最少 | B. | (3)最多 | C. | 都一样多 | D. | 无法确定 |
| A. | 明矾可用于水的消毒、杀菌 | B. | NaHCO3可用于治疗胃酸过多 | ||
| C. | 浓硝酸保存于无色玻璃瓶中 | D. | 氢氟酸可保存于玻璃瓶中 |
| A. | 标准状况下,22.4L的CH4和CH3CH2OH的混合物所含分子数为NA | |
| B. | 常温常压下,18g14CH4所含质子数目为10NA | |
| C. | 标准状况下的22.4L氯气与足量铁反应生成三氯化铁,转移的电子数目为3NA. | |
| D. | 0.1L 1mol/L的NH4C1溶液中存在的NH4+数目为0.1NA. |