题目内容
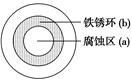
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是( )

A.液滴中的Cl―由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e- 4OH-
4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe 2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e- Cu2+
Cu2+
【答案】
B
【解析】
试题分析:该图形为铁的吸氧腐蚀,液滴覆盖的圆周中心区(a)为负极区 ,发生氧化反应,电极反应为式:Fe-2e-= Fe2+,生成的Fe2+由a区(负极)向b区(正极)迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈,C错误。液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH-,B正确。液滴中的Cl―(阴离子)由b区(正极)向a区(负极)迁移,A错误。若改用嵌 有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则铁仍然为负极,发生的电极反应为:Fe-2e-= Fe2+,D错误。
考点:原电池
点评:本题主要考查原电池的原理,难度不大,解题时需分清正负极对应所发生的反应,仔细审题,准确解题。

练习册系列答案
相关题目
 (2011?浙江)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
(2011?浙江)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( ) (2012?长宁区一模)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
(2012?长宁区一模)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( ) (2011?浙江高考)将 NaCl 溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )
(2011?浙江高考)将 NaCl 溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )