题目内容
 (2012?长宁区一模)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
(2012?长宁区一模)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )分析:NaCl溶液滴到一块光亮清洁的铁板表面上,一段时间后在液滴覆盖的圆周中心区(a)被腐蚀变暗,实际上是发生了吸氧腐蚀,这时,负极电极反应为:Fe-2e-=Fe2+ (发生氧化反应)正极电极反应为:O2+2H2O+4e-=4OH- (发生还原反应)在液滴外沿,由于Fe2++2OH-=Fe(OH)2,4Fe(OH)2+O2+2H2O=4Fe(OH)3 形成了棕色铁锈环(b).
A、氯化钠是中性溶液,在铁表面发生的是吸氧腐蚀;
B、液滴下的Fe因发生氧化反应反应而被腐蚀;
C、液滴边缘是氧气得到电子发生还原反应;
D、铁和铜在电解质溶液中形成原电池,铁做负极失电子发生氧化反应.
A、氯化钠是中性溶液,在铁表面发生的是吸氧腐蚀;
B、液滴下的Fe因发生氧化反应反应而被腐蚀;
C、液滴边缘是氧气得到电子发生还原反应;
D、铁和铜在电解质溶液中形成原电池,铁做负极失电子发生氧化反应.
解答:解:A.氯化钠是中性溶液,液滴下氧气含量少,发生在铁表面发生的是吸氧腐蚀,故A错误;
B.液滴下的Fe因发生氧化反应而被腐蚀,根据在原电池中,阳离子移向正极,阴离子移向负极的规律,Fe2+由a区向b区迁移,故B错误;
C.O2在液滴外沿反应,正极电极反应为:O2+2H2O+4e-=4OH- (发生还原反应),故C正确;
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,由于Fe的金属活动性比铜强,Fe仍为负极,负极发生的电极反应为:Fe-2e-=Fe2+,故D错误.
故选C.
B.液滴下的Fe因发生氧化反应而被腐蚀,根据在原电池中,阳离子移向正极,阴离子移向负极的规律,Fe2+由a区向b区迁移,故B错误;
C.O2在液滴外沿反应,正极电极反应为:O2+2H2O+4e-=4OH- (发生还原反应),故C正确;
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,由于Fe的金属活动性比铜强,Fe仍为负极,负极发生的电极反应为:Fe-2e-=Fe2+,故D错误.
故选C.
点评:本题考查氧化还原反应、电化学等方面知识,注意在原电池中阳离子移向正极,阴离子移向负极.金属腐蚀的吸氧腐蚀和析氢腐蚀的区别,电极反应判断是解题关键,题目难度中等.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
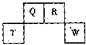 (2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
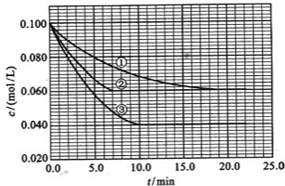






 的分子式为
的分子式为
 以及必要的无机试剂可合成
以及必要的无机试剂可合成 ,写出第一步合成反应的化学方程式
,写出第一步合成反应的化学方程式
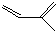 的一种同分异构体A,它的一氯代物有三种.与Br2按1:1加成产物只有一种(不考虑顺反、立体异构),则A的结构简式为
的一种同分异构体A,它的一氯代物有三种.与Br2按1:1加成产物只有一种(不考虑顺反、立体异构),则A的结构简式为
 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.

 )是一种医药中间体.
)是一种医药中间体.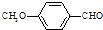 )合成D.用反应流程图表示如下,请将后面一步的反应条件写在箭号下方,试剂或原料写在箭号上方,中间产物填在下图中的方框内.并写出茴香醛与银氨溶液反应的化学方程式.
)合成D.用反应流程图表示如下,请将后面一步的反应条件写在箭号下方,试剂或原料写在箭号上方,中间产物填在下图中的方框内.并写出茴香醛与银氨溶液反应的化学方程式.


 (2012?长宁区一模)Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.
(2012?长宁区一模)Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.