题目内容
【题目】海洋中有丰富的资源,如下图所示利用海水可获得许多化工产品。
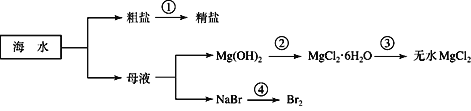
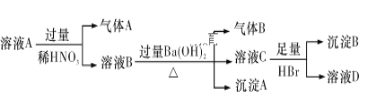
下列有关说法正确的是
A. 第①步中除去粗盐中的Ca2+、Mg2+、SO42-等杂质,加入的试剂顺序为:Na2CO3溶液、NaOH溶液、BaCl2溶液,过滤后加盐酸
B. 第②步是将氢氧化镁与盐酸反应,然后加热蒸干溶液得到晶体
C. 第③步中的反应需在氯化氢气流中进行
D. 第④步中溴元素被还原出来后用四氯化碳萃取
【答案】C
【解析】
根据转化图可以知道,①为粗盐提纯,利用物质之间的发生及除杂的原则来分析;②为物质的转化,根据反应物与生成物的组成来选择试液,;③为结晶水合物失去结晶水的反应;④为制备溴单质的反应,利用反应中溴元素的化合价来分析。
A、除去粗盐中的Ca2+、Mg2+、SO42-等杂质,先除硫酸根离子,需要BaCl2溶液,再除镁离子,需要NaOH溶液,最后除钙离子,加入Na2CO3溶液,故A错误;
B、由②中物质的组成可以知道,氢氧化镁与盐酸反应生成氯化镁和水,然后蒸发浓缩、冷却结晶得到晶体,不能加热蒸干,否则会发生水解,故B错误;
C、由③的转化可以知道,结晶水合物失去结晶水并生成氯化镁的过程中会发生水解,为了抑制水解,第③步中的反应需在氯化氢气流中进行,所以C选项是正确的;
D、由④可以知道NaBr→Br2,NaBr中溴元素的化合价为-1价,单质中溴元素的化合价为0,则在反应中溴元素的化合价升高,由信息可以知道溴元素被氧化,故D错误。
所以C选项是正确的。

【题目】某同学在探究废干电池内的黑色固体回收利用时,进行了如图所示实验:

查阅教材可知,普通锌锰干电池中的黑色物质的主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1)操作②的名称是_____。
(2)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、_____、_____和三脚架;操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为_____。
(3)操作④的试管中加入操作③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色滤渣中含有_____。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
实验目的 | 实验操作 | 实验现象 | 实验结论 |
①检验Cl- | 加入硝酸酸化的硝酸银溶液 | 有白色沉淀产生 | 含有Cl- |
②检验NH4+ | 取少许滤液于试管中, ____ | _____ | 含有NH4+ |
③检验Zn2+ | 取少许滤液于试管中,加入稀氨水 | 先产生白色沉淀,继续加入稀氨水,沉淀又溶解 | 含有Zn2+ |
(5)根据以上实验报告,关于滤液的成分,该同学的结论是滤液中含有NH4Cl和ZnCl2。若想从滤液中得到溶质固体,还应进行的操作是_________。
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图如下:

化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-35 | 10-6 | 10-38 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为______________________。
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___________;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH 至少达到____________,恰好能使Fe3+、A13+沉淀完全。(当离子浓度降到1.0×10-5mol·L-1时即视为沉淀完全)
(3)滤渣B的成分是___________________。
(4)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极电极反应式为_____________________________________________________。
(5)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.9200g该样品,与足量酸性KI 溶液充分反应后,配制成100mL溶液。取其中20.00mL,恰好与25.00mL 0.0800mol·L-1Na2S2O3溶液反应(I2+2S2O32-=2I-+S4O62-)。计算可得该样品纯度_____%。(小数点后保留1位数字)。