题目内容
【题目】(1)______mol CO2 中含有氧原子数跟 1.806×1024 个 H2O 分子含有的氧原子数相同。
(2)标准状况下的甲烷和一氧化碳的混合气体 8.96 L,其质量为 7.60 g,则混合气体中甲烷的体积为______;一氧化碳的质量为_________。
(3)等物质的量 O2 和臭氧(O3),其质量之比为____。若 O2 和 O3 质量相等,则其原子数之比为____。
(4)200 毫升含 MgCl2、KCl、Na2SO4 三种溶质的混合液中,已知其中含 Cl-1.5 mol,K+和 Na+共1.5 mol,Mg2+为 0.5 mol,则 SO42-的物质的量浓度为__________________。
【答案】1.5 6.72L 2.8g 2:3 1:1 2.5mol/L
【解析】
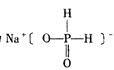
:(1)要使二氧化碳分子、水分子含有氧原子个数相等,则二者含有氧原子物质的量相等,应满足:n(CO2)×2=![]() ×1,解得n(CO2)=1.5mol,故答案为:1.5;
×1,解得n(CO2)=1.5mol,故答案为:1.5;
(2)设CH4为x,CO为y,则x+y=![]() 、16x+28y=7.60g,解得:x=0.3,y=0.1,即CH4为0.3 mol,CO为0.1mol,则甲烷体积为:0.3mol×22.4L/mol=6.72 L; CO质量为:0.1mol×28g/mol=2.8 g,故答案为:6.72L;2.8g;
、16x+28y=7.60g,解得:x=0.3,y=0.1,即CH4为0.3 mol,CO为0.1mol,则甲烷体积为:0.3mol×22.4L/mol=6.72 L; CO质量为:0.1mol×28g/mol=2.8 g,故答案为:6.72L;2.8g;
(3)依据m=nM可知,二者质量之比等于二者相对分子质量之比,所以等物质的量O2和臭氧(O3),其质量之比为:32:48=2:3;若O2和O3质量相等,其原子数之比为:![]() ×2×NA:
×2×NA:![]() ×3×NA=1:1;故答案为:2:31:1;
×3×NA=1:1;故答案为:2:31:1;
(4)溶液呈电中性,由电荷守恒可知:n(Cl-)+2n(SO42-)=n(K+)+n(Na+)+2n(Mg2+),即:1.5mol+2n(SO42-)=1.5mol+2×0.5mol,解得n(SO42-)=0.5mol,c(SO42-)=![]() =2.5mol/L,故答案为:2.5mol/L。
=2.5mol/L,故答案为:2.5mol/L。

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案【题目】面对全球近期的气候异常,环境问题再次成为焦点。SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径。
(1)已知:H2O(g)=H2O(l) ΔH1=-Q1 kJ/mol
C2H5OH(g)=C2H5OH(l) ΔH2=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2 (g)+3H2O(g) ΔH3=-Q3 kJ/mol
则23g液态酒精完全燃烧并恢复至室温放出的热量为________________kJ。
(2)下表为反应2SO2(g)+O2 (g)![]() 2SO3(g)的相应温度下平衡常数的数值,由此得出该反应的ΔH__________0(填“>”“=”或“<”)。
2SO3(g)的相应温度下平衡常数的数值,由此得出该反应的ΔH__________0(填“>”“=”或“<”)。
T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 2.6 | 1.9 | 1.0 | 0.7 | 0.6 |
(3)①已知:在2L密闭容器中,17℃、1.01×105Pa条件下,2NO2(g)![]() N2O4(g) ΔH<0的平衡常数K=13.3。当此反应达到平衡时,若n(NO2)=0.060mol,则c(N2O4)=_______(保留两位有效数字)。
N2O4(g) ΔH<0的平衡常数K=13.3。当此反应达到平衡时,若n(NO2)=0.060mol,则c(N2O4)=_______(保留两位有效数字)。
②若改变上述体系的某个条件,达到新的平衡后,测得混合气体中c(NO2)=0.040mol/L,c(N2O4)=0.0070mol/L,则改变的条件是______________。
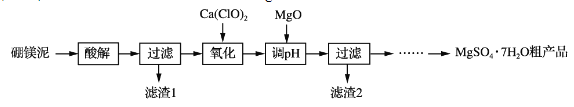
【题目】实验室用硼镁泥为原料制取MgSO4·7H2O粗产品的过程如下:
硼镁泥的主要成分如下表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
(1)“酸解”时为提高Mg2+的浸出率,可采用的措施是_____(写一种)。所加酸不宜过量太多的原因是_____。
(2)“氧化”步骤中,若用H2O2代替Ca(ClO)2,则发生反应的离子方程式为______________。实际未使用H2O2,除H2O2成本高外,还可能的原因是______________________________________。
(3)“调pH”时用MgO而不用NaOH溶液的原因是________________________。
(4)结合附表信息,由MgSO4·7H2O粗产品(含少量CaSO4)提纯获取MgSO4·7H2O的实验方案如下:将粗产品溶于水,_________________________________________________,室温下自然挥发干燥。(实验中必须使用的试剂有:饱和MgSO4溶液,乙醇)附:两种盐的溶解度(g/100 g水)
温度℃ | 10 | 30 | 40 | 50 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 |