题目内容
在盛有足量M的体积可变的密闭容器中加入N,发生反应:M (s) +2N (g)==4P (s) +Q (g) ΔH< 0。在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的变化关系如图所示。下列说法正确的是
| A.平衡是N的转化率为50% |
| B.当温度升高后,则图中θ>450 |
| C.若再加入N,则正、逆反应速率均逐渐增大 |
| D.若再加入N,则反应体系中气体密度减小 |
A
解析试题分析:A、根据图像,平衡时生成物P的物质的量与起始时加入N的物质的量相等,根据M (s) +2N (g)=4P (s) ,可知平衡时N反应了50%,正确;B、因为该反应的ΔH<0,为放热反应,所以温度升高,平衡向逆反应方向移动,则图中θ< 450,错误;C、若再加入N,正反应速率瞬时变大,随着平衡的移动,再逐渐变小,错误;D、因为气体的质量变化不确定,所以密度的变化也无法确定,错误。
考点:本题考查化学平衡的移动、转化率的计算。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案下列关于化学反应速率的说法中正确的是( )
| A.决定化学反应速率的主要因素是温度 |
| B.反应速率用于衡量化学反应进行快慢 |
| C.可逆反应达到平衡状态时正逆反应的速率都为0 |
| D.增大反应物的量或提高反应温度一定能增大反应速率 |
下列有关说法错误的是
| A.为保护海轮的船壳,常在船壳上镶入锌块 |
| B.纯碱溶于热水中,去污效果增强,说明纯碱的水解反应是吸热反应 |
| C.已知工业合成氨气△H<0,达平衡后,升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
| D.NH3(g) + HCl(g)="=" NH4Cl(s)较低温度下能自发进行,说明该反应的△H<0 |
下列叙述表示可逆反应N2 + 3H2 2NH3一定处于平衡状态的是……… ( )
2NH3一定处于平衡状态的是……… ( )
| A.N2、H2、NH3的百分含量相等 | B.3v(N2)正= v(H2)逆 |
| C.定容容器中,气体的密度不变 | D.N2、H2、NH3的浓度之比为1:3:2 |
恒温下,在容积为1升的甲、乙两个恒容密闭容器中分别充入H2和I2发生可逆
H2(g) +I2(g) 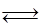 2HI(g) ΔH =" -14.9" kJ/mol,实验时有关数据如下表:
2HI(g) ΔH =" -14.9" kJ/mol,实验时有关数据如下表: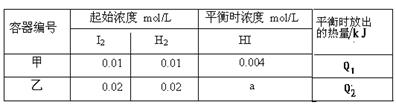
下列判断正确的
| A.平衡时,乙中颜色更深,a>0.008 |
| B.平衡时,放出的热量:Q1=1/2Q2 =0.149kJ |
| C.该温度下,该反应的平衡常数K="4" |
| D.平衡后,向甲中再冲入0.004 mol HI气体,再次达到平衡时HI的百分含量不变 |
硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。有关接触氧化反应
2SO2 + O2 2SO3的说法中正确的是
2SO3的说法中正确的是
| A.只要选择适宜的条件,SO2和O2就能全部转化为SO3 |
| B.该反应达到平衡后,反应就完全停止了,即正逆反应速率为零 |
| C.若用18O原子组成的O2参加反应,平衡时SO2中也会含有18O |
| D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
可逆反应mA(g)+nB(g) pC(g)+qD(g)的v-t图象如下右图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下右图:①a1>a2②a1<a2③b1>b2④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是
pC(g)+qD(g)的v-t图象如下右图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下右图:①a1>a2②a1<a2③b1>b2④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是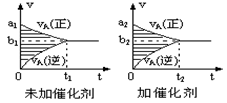
| A.②③⑤⑧ | B.①④⑥⑧ | C.②④⑤⑦ | D.①③⑥⑦ |
下列有关说法正确的是
| A.CaCO3(s) =CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
| C.N2(g)+3H2(g) =2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2 )和H2的平衡转化率均增大 |
| D.水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应 |
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如下图所示。下列判断正确的是
| A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等 |
| B.溶液酸性越强,R的降解速率越小 |
| C.R的起始浓度越小,降解速率越大 |
| D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1 |