题目内容
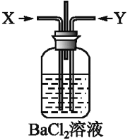
【题目】请分析下图装置。

⑴Fe电极是_____(填“正”或“负”)极,其电极反应为________;
⑵Cu电极是_____电极,其电极反应为________________。
⑶若用浓硝酸做电解质溶液____做负极。
【答案】负 Fe-2e-=Fe2+ 正 2H++2e-=H2↑ Cu
【解析】
Cu、Fe和稀硫酸构成原电池,Fe失电子发生氧化反应作负极,电极反应为Fe-2e-=Fe2+,Cu为正极,正极上氢离子得电子发生还原反应,电极反应为2H++2e-=H2,总反应为Fe+2H+=Fe2++H2↑,据此分析解答。
(1)Cu、Fe和稀硫酸构成原电池,Fe失电子发生氧化反应作负极,电极反应为Fe-2e-=Fe2+,故答案为:负;Fe-2e-=Fe2+;
(2)Cu、Fe和稀硫酸构成原电池,Fe失电子作负极,Cu为正极,正极上氢离子得电子发生还原反应,正极的电极反应为:2H++2e-=H2↑,故答案为:正;2H++2e-=H2↑;
(3)若用浓硝酸做电解质溶液,Cu、Fe和浓硝酸构成原电池,由于铁发生钝化,铜能与浓硝酸反应,则铜为负极,电池总反应为Cu+4H++2NO3-=Cu2+ +2NO2↑+2H2O,故答案为:Cu。

 高中必刷题系列答案
高中必刷题系列答案【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
【题目】铝鞣剂在皮革工业有广泛应用。某学习小组以铝灰为原料制备铝鞣剂[ Al(OH)2Cl],设计如下化工流程(提示:铝灰的主要成分是Al、Al2O3、AlN、FeO等):
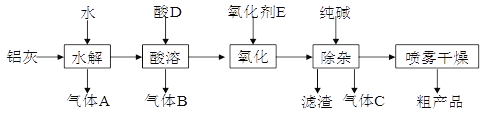
请回答下列问题:
(1)酸D的化学式为__________;气体C的电子式___________。
(2)实验室检验气体A的操作是________________;“水解”温度保持在90℃左右,写出水解生成A的化学方程式:________________________。
(3)“酸溶”温度控制在30℃~35℃,不宜太低,也不宜太高,其原因是_________________;氧化剂E宜选择_________(填字母)。
A.漂白液 | B.稀硝酸 | C.酸性高锰酸钾溶液 | D.溴水 |
(4)“除杂”过程中产生滤渣的离子方程式为_________________________。
(5)粗产品略显浅黄色,可能含有的杂质主要是_________________(填化学式)。
若用“蒸发”代替“喷雾干燥”,其后果是____________________________。