题目内容
(15分)铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为 。
②图中A、B、C、D四个区域,生成铁锈最多的是 (填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为 。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 。
③上述生产流程中,能体现“绿色化学”思想的是 (任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
⑴①吸氧腐蚀 ②B
⑵①4HNO3 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
②4Fe+10HNO3=4 Fe(NO3)2+NH4NO3+3H2O
③氮氧化物排放少(或其他合理答案)
⑶①4:1 ②0.05
解析试题分析:⑴①钢铁在海水(中性环境)中发生的应该是吸氧腐蚀。
②在B点的海水中氧气浓度最大,发生的吸氧腐蚀最快,生成的铁锈最多。
⑵①硝酸受热分解产生NO2、O2、H2O,通过氧化还原反应的化合价升降法将其配平。
②通过示意图分析,确定HNO3与Fe该反应的生成物除了Fe(NO3)2还有NH4NO3,先根据得失电子守恒有4Fe+10HNO3--4 Fe(NO3)2+ NH4NO3,再根据原子守恒得4Fe+10HNO3=4 Fe(NO3)2+ NH4NO3+3H2O。
③该生产流程中生成了NH4NO3,没有产生NO、NO2等有毒气体,减少了氮氧化物的排放量,符号“绿色化学”思想。
⑶①据题意有K=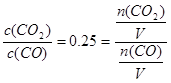 ,则n(CO):n(CO2)=4:1。
,则n(CO):n(CO2)=4:1。
②据题意有n(CO):n(CO2)=(x-0.01):0.01=4:1,解得x=0.05 mol。
考点:本题考查金属的电化学腐蚀原理,反应方程式的书写,化学平衡常数的有关计算。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案2013年9月,中国华北华中地区发生了严重的雾霆天气,北京?河北?河南等地的空气污染升为6级空气污染,属于重度污染?汽车尾气?燃煤废气?冬季取暖排放的CO2等都是雾霆形成的原因?
(1)汽车尾气净化的主要原理为; , 在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态?
, 在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态?
①能判断该反应达到平衡状态的标志是 ?
| A.在单位时间内生成1molCO2的同时消耗了lmolCO |
| B.混合气体的密度不再改变 |
| C.混合气体的平均相对分子质量不再改变 |
| D.混合气体的压强不再变化 |

(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应为:

①该反应在 下能自发进行(填“高温”或“低温”)?
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为 ?(已知:
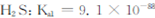 ;
; ?
? ;
;  ?)
?) (3)已知反应:
 ,现将不同量的CO(g)和H20(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
,现将不同量的CO(g)和H20(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据: 
①实验1条件下平衡常数K= (保留小数点后二位)?
②实验3中,若平衡时,CO的转化率大于水蒸气,则a?b必须满足的关系是 ?
③该反应的
 0(填“<”或“>”);
0(填“<”或“>”); (5分)氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家。
(1)右图表示温度为T K时氮气与氢气合成氨反应过程中的能量变化, 写出该反应的热化学方程式 。
(2)已知在TK温度下合成氨反应在2.00L的密闭容器中进行。得到如下数据:
| 时间(h) 物质的量(mol) | | 0 | 1 | 2 | 3 | 4 |
| N2 | | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
根据表中数据计算:
①0~1h内N2的平均反应速率为mol/(L·h)。
②反应进行到2h时放出的热量为 kJ。
③此条件下,反应:N2 + 3H2
 2NH3的化学平衡常数K = (保留两位小数)。
2NH3的化学平衡常数K = (保留两位小数)。④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,化学平衡移动的方向是 (填“正反应”或“逆反应”或“不移动”)。
.(16分)Ⅰ.已知下列反应的热化学方程式为:
(1) C(s) + O2(g) = CO2(g) △H1 =" -393.5" kJ/mol
(2) CH3COOH(l) + 2O2(g) = 2CO2(g) + 2H2O(l) △H2 =" -870.3" kJ/mol
(3) 2H2(g) + O2(g) = 2H2O(l) △H3 =" -571.6" kJ/mol
请计算:2C(s) + 2H2(g) + O2(g)= CH3COOH(l) △H4 = 。
Ⅱ.在某温度下,物质(t-BuNO)2在正庚烷或CCl4溶剂中均可以发生反应:
(t-BuNO)2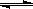 2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。
2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。
(1)向1L正庚烷中加入0.50mol(t-BuNO)2,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为60%(假设反应过程中溶液体积始终为1L)。反应在前10min内的平均速率为ν(t-BuNO)= 。列式计算上述反应的平衡常数K = 。
(2)有关反应:(t-BuNO)2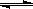 2(t-BuNO) 的叙述正确的是( )
2(t-BuNO) 的叙述正确的是( )
A.压强越大,反应物的转化率越大 B.温度升高,该平衡一定向右移动
C.溶剂不同,平衡常数K值不同
(3)通过比色分析得到40℃时(t-BuNO)2和(t-BuNO)浓度随时间的变化关系的几组数据如下表所示,请在同一图中绘出(t-BuNO)2和(t-BuNO)浓度随时间的变化曲线。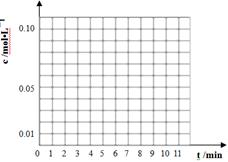
| 时间(min) | 0 | 1 | 3 | 5 | 7 | 9 | 11 |
| c(t-BuNO)2 mol/L | 0.05 | 0.03 | 0.01 | 0.005 | 0.003 | 0.002 | 0.002 |
| c(t-BuNO) mol/L | 0 | 0.04 | 0.08 | 0.07 | 0.094 | 0.096 | 0.096 |
碘在科研与生活中有重要应用,某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I- 2SO42-+I2(慢) I2+2S2O32-
2SO42-+I2(慢) I2+2S2O32- 2I-+ S4O62-(快)
2I-+ S4O62-(快)
向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-)∶n(S2O82-) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx mL,理由是 。
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)

碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为:2Li(s)+I2(s)
 2LiI(s)ΔH
2LiI(s)ΔH已知:①4Li(s)+O2(g)
 2Li2O(s) ΔH1 ②4LiI(s)+O2(g)
2Li2O(s) ΔH1 ②4LiI(s)+O2(g) 2I2(s)+2Li2O(s)ΔH2
2I2(s)+2Li2O(s)ΔH2则电池反应的ΔH= ;碘电极作为该电池的 极。

 Fe( s) +CO2(g)的平衡常数K= 0.25。
Fe( s) +CO2(g)的平衡常数K= 0.25。 CH3OCH3(g) + H2O(g)。已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2) / n(CO)]的变化曲线如下左图:
CH3OCH3(g) + H2O(g)。已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2) / n(CO)]的变化曲线如下左图: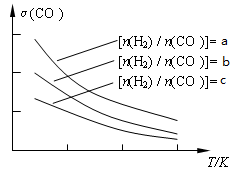
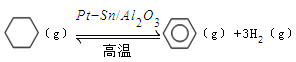 。某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol/L,平衡时苯的浓度为bmol/L,该反应的平衡常数K=_____。
。某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol/L,平衡时苯的浓度为bmol/L,该反应的平衡常数K=_____。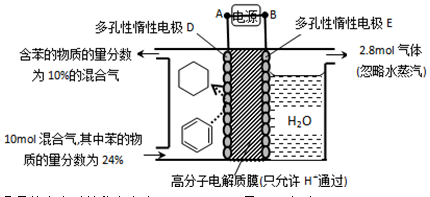
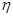 =_____(
=_____( ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)


