题目内容
【题目】I. 如下图所示,50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在装置中进行中和反应。通过测定反应过程中所放出的热量,可计算中和热,回答下列问题:
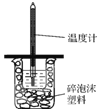
(1)图中装置缺少的仪器是 _______________。
(2)下列说法不正确的是________________ (填序号)。
A.若用50mL 0.55mol·L-1Ba(OH)2溶液代替NaOH溶液进行实验,测得的中和热相同
B.若用50mL 0.50mol·L-1醋酸溶液代替盐酸进行实验,测得的中和热相同
C.若分别用等浓度的硫酸和Ba(OH)2溶液代替盐酸和NaOH溶液进行实验,测得的中和热相同
D.NaOH溶液稍过量的原因是让盐酸完全反应
II.某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞;
B.用标准溶液润洗滴定管2-3次;
C.把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液;
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm;
E.调节液面至0或0刻度以下,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度。完成以下填空:
(1)正确操作的顺序是(用序号字母填写)___________________.
(2)实验中眼睛注视_____________,直至滴定终点。判断到达终点的现象是___________。
(3)若三次实验所用KOH溶液体积分别为14.98 mL,16.80 mL,15.02 mL,则c(HCl)=______。
(4)下列操作中,可能造成测定结果偏高的是________________。
A. 未用标准液润洗碱式滴定管
B. 滴定终点读数时,俯视滴定管中液面刻度,其它操作均正确
C. 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
【答案】环形玻璃搅拌棒 BC BDCEAF或ABDCEF 锥形瓶中溶液的颜色变化 锥形瓶中溶液的颜色由无色变浅红色且半分钟内不褪色 0.075mol/L AD
【解析】
I.(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(2)A.中和热的含义是稀的强酸和强碱溶液反应生成1mol水的过程中所放出的热量,可用50mL0.55molL-1Ba(OH)2溶液代替NaOH溶液进行实验求出的中和热数值相同,故A正确;B.醋酸是弱电解质存在电离平衡过程是吸热过程,随反应进行,反应放出的热量减小,所以不可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验,故B错误;C.硫酸与Ba(OH)2溶液反应除了生成水外,还生成了BaSO4沉淀,该反应中的生成热会影响反应的反应热,所以不能用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热,故C错误;D.为了使反应充分进行,应使一方过量,所以NaOH溶液稍过量的原因是让盐酸完全反应,故D正确;故选BC;
II.(1)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,则正确的顺序为BDCEAF,故答案为:BDCEAF;
(2)滴定时,滴定过程中,两眼应该注视锥形瓶内溶液的颜色变化,以判断滴定终点;滴定时,锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色,可说明达到滴定终点;
故答案为:锥形瓶中溶液的颜色变化;锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色;
(3)三次实验所用KOH溶液体积分别为14.98mL,16.80mL,15.02mL,第二组数据相差较大,舍去,其他两次所用标准液的平均体积为15.00mL,
HCl ~~~~ KOH
1 1
c(HCl)×20.00mL 0.1mol/L×15.00mL
c(HCl)×20.00mL=0.1mol/L×15.00mL,解得:c(HCl)=0.075mol/L,故答案为:0.075mol/L;
(4)A.未用标准液润洗碱式滴定管,标准液被稀释,浓度偏小,消耗的标准液的体积偏大,根据c(待测)=![]() 分析,可知c(待测)偏大,故A正确;B.滴定终点读数时,俯视滴定管中液面刻度,消耗的标准液的体积偏小,根据c(待测)=
分析,可知c(待测)偏大,故A正确;B.滴定终点读数时,俯视滴定管中液面刻度,消耗的标准液的体积偏小,根据c(待测)=![]() 分析,可知c(待测)偏小,故B错误;C.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗,待测液的物质的量不变,标准液的体积不变,根据c(待测)=
分析,可知c(待测)偏小,故B错误;C.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗,待测液的物质的量不变,标准液的体积不变,根据c(待测)=![]() 分析,可知c(待测)不变,故C错误;D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,消耗的标准液的体积偏大,根据c(待测)=
分析,可知c(待测)不变,故C错误;D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,消耗的标准液的体积偏大,根据c(待测)=![]() 分析,可知c(待测)偏大,故D正确;故选AD。
分析,可知c(待测)偏大,故D正确;故选AD。

 寒假学与练系列答案
寒假学与练系列答案