题目内容
【题目】肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4H2O+NaCl
实验一:制备NaClO溶液
(1)将氯气通入到盛有NaOH的锥形瓶中,锥形瓶中发生反应的离子方程式是
;
实验二:制取水合肼(实验装置如图所示)控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充 分反应.加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分.(已知:N2H4H2O+2NaClO=N2↑+3H2O+2NaCl)
(2)分液漏斗中的溶液是(填标号A或B);
A.NaOH和NaClO混合溶液
B.CO (NH2) 2溶液
选择的理由是
实验三:测定馏分中肼含量
水合肼具有还原性,可以生成氮气.测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体,经稀释、转移、定容等步骤,配制250mL溶液.
b.移取25.00mL于锥形瓶中,加入10mL水,摇匀.
c.用0.2000mol/L碘溶液滴定至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右.记录消耗碘的标准液的体积.
d.进一步操作与数据处理
(3)水合肼与碘溶液反应的化学方程式;滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是
(4)滴定时,碘的标准溶液盛放在 滴定管中(选填:“酸式”或“碱式”);若本次滴定消耗碘的标准溶液为18.00mL,馏分中水合肼(N2H4H2O)的质量分数为(保留三位有效数字);
(5)为获得更可靠的滴定结果,步骤d中进一步操作主要是: . 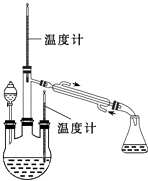
【答案】
(1)Cl2+2OH﹣=ClO﹣+Cl﹣+H2O
(2)A;如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化
(3)N2H4?H2O+2I2=N2↑+4HI+H2O;生成的HI与NaHCO3反应
(4)酸式;18.0%
(5)重复步骤b和c2~3次,依据测得的结果,取平均值
【解析】解:(1)氯气通入到盛有NaOH的锥形瓶中发生反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH﹣=ClO﹣+Cl﹣+H2O;
所以答案是:Cl2+2OH﹣=ClO﹣+Cl﹣+H2O;(2)依据制取水合肼(N2H4H2O)的反应原理为:CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4H2O+NaCl,结合反应产物和反应物分析判断,分液漏斗中的溶液是NaOH和NaClO混合溶液;水合肼(N2H4H2O)具有还原性,易被次氯酸钠氧化,如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化;
所以答案是:A,如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化;(3)水合肼与碘溶液反应发生氧化还原反应,生成氮气、碘化氢和水,反应的化学方程式为:N2H4H2O+2I2=N2↑+4HI+H2O;NaHCO3能控制溶液的pH在6.5左右,是因为碳酸氢钠和碘化氢反应;
所以答案是:N2H4H2O+2I2=N2↑+4HI+H2O,生成的HI与NaHCO3 反应;(4)碘单质具有氧化性,选择酸式滴定管盛装进行实验;结合反应定量关系计算得到馏分中水合肼(N2H4H2O)的质量分数,
N2H4H2O+ | 2I2=N2↑+4HI+H2O |
1 | 2 |
n | 0.2000mol/L×0.018L |
n=0.0018mol
250ml溶液中含有的物质的量=0.0018mol× ![]() =0.018mol
=0.018mol
水合肼(N2H4H2O)的质量分数= ![]() ×100%=18.0%
×100%=18.0%
所以答案是:酸式,18.0%;(5)为获得更可靠的滴定结果,步骤d中进一步操作是重复bc几次,结合测定结果计算体积的平均值,得到结果更准确;
所以答案是:重复步骤b和c 2~3次,依据测得的结果,取平均值;

 阅读快车系列答案
阅读快车系列答案