��Ŀ����
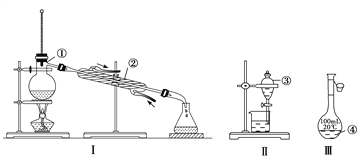
����Ŀ����Ȼ���е����ʾ�������Ի�������ʽ���ڣ�Ϊ�˱����о������ã�����Ի������з�����ᴿ������A��B��C��D����ѧ�����Ļ���������ᴿ��װ�á�
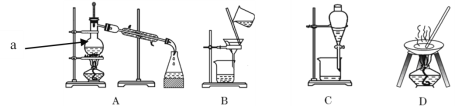
I������ݻ���������ᴿ��ԭ�����ش�������ʵ������Ҫʹ������װ�á���A��B��C��D �����ʵ��Ŀո��С�
��1��̼�������Һ�з����̼���___________��
��2���Ȼ�����Һ�з�����Ȼ���___________��
��3������ֲ���ͺ�ˮ___________��
��4����ˮ����___________��
��5���Ȼ�����Һ�з����ˮ___________��
��6����ȥ����ˮ�е�Cl��������___________��
��7���ӵ�ˮ�з����I2___________��
II����ˮ����ȡ�ⵥ�ʵķ������£�
��1����ȡ��Һ
�����п���Ϊ��ˮ����ȡ�ⵥ����ȡ������___________
A���ƾ� B����
�ڷ�Һ©����ʹ��ǰ������___________
�۲����ϵ�֪���ѣ�H2O��>��������>�����ƾ��������â�����ѡ��ȡ����ȡ��ˮ�еĵⵥ�ʣ���Һʱ��ˮ��Ӧ�ɷ�Һ©����______�˿ڷų����л���Ӧ�ɷ�Һ©����______�˿ڷų���������������������������
��2������
��װ��A��a��������_______������װ��������ˮӦ��________�ڽ�����������������������
��������Ŀ����________________________��װ��C�ڷ�ҺʱΪʹҺ��˳�����£�����©���¶˵������⣬��Ӧ���еľ��������__________________________��
����֪������Ȼ�̼���۷е��������±�
�۵� | �е� | |
�� | 113.7�� | 184.3�� |
���Ȼ�̼ | -22.6�� | 76.8�� |
���������������Ȼ�̼�Ļ�����ƿ�����ռ��������ʵ�������___________��
��. ��ˮ���̲��ŷḻ����Դ����ʵ������ȡ������ˮ�������������̵�ʵ�飺
[��ˮ]![]() [����]
[����]![]() [ʳ��ˮ]��[�Ȼ��ƾ���]
[ʳ��ˮ]��[�Ȼ��ƾ���]
����һ�������к�Ca2+��Mg2+��SO42�������ʣ���Ҫ�ᴿ������ۺ������������ᴿ�IJ����У�
�����������Na2CO3��Һ�������������BaCl2��Һ�������������NaOH��Һ����������Һ��pH����7�����ܽ� �����ˡ���������ȷ�IJ���˳����__________����ѡ����ĸ��.
a.�ݢڢۢ٢ޢܢ� b���ݢ٢ڢۢޢܢ� c���ݢڢ٢ۢܢޢ� d���ݢۢڢ٢ޢܢ�
��������ɺ�ˮ���Ȼ��ƾ����ʵ�������Ҫ�õ�����Ҫװ����_________________���Ӹ���������װ����ѡ������ĸ����
�������������к���������ɳ��CaCl2��MgCl2�������Σ��������ܽ���ȹ��˽���ɳ��ȥ���ټ�����Һ�е�SO42����������Һ�е�SO42����ʵ�������������______________________________��
���𰸡�BDCAAACB����Ƿ�©Һ����������ƿ��ʹˮ���������ܣ�ˮ�����������������෴������Ч�����ý���Һ©�����ϵIJ�������ʹ���ϵİ��۶�©���ϵ�С�����Ȼ�̼adBDȡ������Һ���Թ��У��μ����������ữ��BaCl2��Һ�����а�ɫ����������˵������SO42����
��������
I����1��̼�������Һ�з����̼��ƣ�̼��Ʋ�����ˮ������ͨ�����˲������룬��Ӧ��ѡ��װ��B���ʴ�Ϊ��B��
��2���Ȼ�����Һ�з�����Ȼ��ƣ���Ҫͨ������������ɣ�Ӧ��ѡ��װ��D���ʴ�Ϊ��D��
��3������ֲ���ͺ�ˮ�����������ܣ�����ͨ����Һ������ɣ�Ӧ��ѡ��װ��C���ʴ�Ϊ��C��
��4����ˮ��������Ҫͨ�����������ȥˮ�е��Ȼ��Ƶ��ѻӷ������ʣ�ѡ�õ�װ��ΪA���ʴ�Ϊ��A��
��5���Ȼ�����Һ�з����ˮ���Ȼ��Ʒе�ϸߣ�����ͨ�����������ɣ�����Ӧ��ѡ��װ��A���ʴ�Ϊ��A��
��6����ȥ����ˮ�е�Cl�������ʣ����ʵķе�ϸߣ�����ͨ�����������ɣ�����Ӧ��ѡ��װ��A���ʴ�Ϊ��A��
��7���ӵ�ˮ�з����I2����Ҫͨ����ȡ������Ȼ��ͨ����Һ������ɣ�Ӧ��ѡ��װ��C���ʴ�Ϊ��C��
II����1������ˮ����ȡ�ⵥ�ʣ���Ҫͨ����ȡ������ѡȡ����ȡ��������ˮ���ܣ����Բ���ѡ��A�ƾ�������ѡ�ñ����ʴ�Ϊ��B��
����Һ©����ƿ��������������Һ©��ǰ�������Һ©���Ƿ�©Һ���ʴ�Ϊ������Ƿ�©Һ��
�������ѣ�H2O�����������������ñ�Ϊ��ȡ����ȡ��ˮ�еĵⵥ�ʣ��л������Ϸ���ˮ�����²㣬���Һʱ��ˮ��Ӧ�ɷ�Һ©�����϶˿ڷų����л���Ӧ�ɷ�Һ©�����¶˿ڷų����ʴ�Ϊ���£��ϣ�
��2����װ��A��a����Ϊ������ƿ����������ͨˮʱ��ͨ����������ͨˮ�������������ܵ��¿ڽ�ˮ������Ч������ã�װ��C�ڷ�ҺʱΪʹҺ��˳�����£�����©���¶˵������⣬����Ҫ����Һ©�����ϵIJ�������ʹ���ϵİ��۶�©���ϵ�С�����ʴ�Ϊ��������ƿ���£�ʹˮ���������ܣ�ˮ�����������������෴������Ч������������Һ©�����ϵIJ�������ʹ���ϵİ��۶�©���ϵ�С����
�����ݱ��еⵥ�ʺ����Ȼ�̼�ķе��֪�����Ȼ�̼�ķе�ϵͣ������Ȼ�̼���ȱ���������ƿ�����ռ���������Ϊ���Ȼ�̼���ʴ�Ϊ�����Ȼ�̼��
��. ����һ����ȥ�����еĿ��������ʣ�Mg2+��Ca2+��Fe3+��SO42-ʱ�����Լ������NaOH��ȥ��þ���Ӻ������ӣ���Mg2++2OH-=Mg��OH��2����Fe3++3OH-�TFe��OH��3�����������BaCl2��ȥ����������ӣ���SO42-+Ba2+=BaSO4�����������Na2CO3��ȥ�������ӺͶ���ı����ӣ���Ca2++CO32-=CaCO3��̼���Ʊ�������Ȼ���֮���������ƺ��Ȼ������Եߵ������˳��Ȼ�������Һ��pH����7���������ɣ��������˳��Ϊ�ݢڢۢ٢ޢܢ����ݢۢڢ٢ޢܢ����ʴ�Ϊ��ad��
��������ɺ�ˮ���Ȼ��ƾ����ʵ�������Ҫ�õ������ķ�����Ϊ��ȥ���ʣ�Ӧ���ˣ���Ҫװ����BD���ʴ�Ϊ��BD��
��������SO42-�뱵���ӷ�Ӧ���ɲ�����ǿ������ᱵ�������ݴ˿ɼ�����������ӣ����Լ�����Һ��SO42-��ʵ�����Ϊ��ȡ������Һ��С�Թ��У��μ����������ữ��BaCl2��Һ�����а�ɫ����������˵������SO42-���ʴ�Ϊ��ȡ������Һ��С�Թ��У��μ����������ữ��BaCl2��Һ�����а�ɫ����������˵������SO42-��