题目内容
16.设NA为阿伏加德罗常数的数值.下列有关叙述不正确的是( )| A. | 44 g乙醛中所含的氧原子数为NA | |
| B. | 常温常压下,8gCH4含有5 NA个电子 | |
| C. | 标准状况下,22.4L苯含有NA个C6H6分子 | |
| D. | 14 g乙烯中所含的C-H键数目为2NA |
分析 A、求出乙醛的物质的量,然后根据乙醛中含1个氧原子来分析;
B、求出甲烷的物质的量,然后根据甲烷中含10个电子来分析;
C、标况下苯为液体;
D、求出乙烯的物质的量,然后根据乙烯中含4个H原子来分析.
解答 解:A、44g乙醛的物质的量为1mol,而乙醛中含1个氧原子,故1mol乙醛中含NA个氧原子,故A正确;
B、常温常压下8g甲烷的物质的量为0.5mol,而甲烷中含10个电子,故0.5mol甲烷中含5NA个电子,故B正确;
C、标况下苯为液体,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、14g乙烯的物质的量为0.5mol,而乙烯中含4个H原子,故0.5mol乙烯中含2NA条C-H键,故D正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
6.二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构中每个原子均满足8电子结构,常温下,S2Cl2就是一种橙黄色的液体,易与水反应,并产生能使品红褪色的气体.下列说法中错误的是( )
| A. | S2Cl2中的硫元素显+1 价 | |
| B. | S2Cl2属于共价化合物 | |
| C. | S2Cl2与水的反应属于复分解反应 | |
| D. | S2Cl2与H2O反应的生成物中可能有S |
7. 在恒容密闭容器中加入一定量的反应物后存在下列平:CO(g)+H2O(g)?CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示,下列说法正确的是( )
在恒容密闭容器中加入一定量的反应物后存在下列平:CO(g)+H2O(g)?CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示,下列说法正确的是( )
 在恒容密闭容器中加入一定量的反应物后存在下列平:CO(g)+H2O(g)?CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示,下列说法正确的是( )
在恒容密闭容器中加入一定量的反应物后存在下列平:CO(g)+H2O(g)?CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示,下列说法正确的是( )| A. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 | |
| B. | 在T2时,若反应处于状态D,则一定有ν正<ν逆 | |
| C. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| D. | 若T1、T2时的平衡常数分别为K1、K2,则K1>K2 |
4.有关乙酸与甲酸甲酯的说法中不正确的是( )
| A. | 两者都可以和NaOH溶液反应 | B. | 可利用水将两者区分开 | ||
| C. | 两者互为同分异构体 | D. | 两者互为同系物 |
11.某烃结构简式为 ,有关其结构的说法正确的是( )
,有关其结构的说法正确的是( )
 ,有关其结构的说法正确的是( )
,有关其结构的说法正确的是( )| A. | 所有碳原子可能在同一平面上 | B. | 所有碳原子可能在同一条直线上 | ||
| C. | 最多有18个原子在同一平面上 | D. | 最多有7个原子在同一直线上 |
1.下列措施能加快化学反应速率的是( )
| A. | 将食物放入冰箱 | B. | 向炉膛鼓风 | ||
| C. | 钨丝灯泡中抽成近真空 | D. | 食物袋中放入小包除氧剂 |
8.某有机物的结构简式如图所示,有关该有机物的叙述不正确的是( )


| A. | 在一定条件下,能发生取代、酯化和加聚反应 | |
| B. | 该物质能使酸性KMNO4溶液褪色 | |
| C. | lmol该物质最多可与5molH2发生加成反应 | |
| D. | lmol该物质完全燃烧最多可消耗13mol氧气 |
5.如图,将铁棒和碳棒用导线连接后插入稀硫酸中,构成原电池.下列叙述不正确的是( )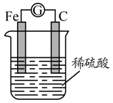

| A. | 电子从碳棒经导线流向铁棒 | B. | 铁棒是负极,碳棒是正极 | ||
| C. | 电池反应为:Fe+2H+=Fe2++H2↑ | D. | 碳棒上有气体放出,溶液c(H+)减小 |
19.根据下列实验操作和现象所得到的结论不正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | pH=3的某酸跟pH=11的某碱等体积混合,往其中滴加酚酞,溶液变红 | 生成强碱弱酸盐 |
| B | Mg(OH)2(s)加入CH3COONH4溶液中,固体溶解 | NH4+与OH-结合成NH3•H2O 使Mg(OH)2的溶解平衡右移 |
| C | 室温下,用pH试纸测得:0.lmol•Na2SO3溶液的pH约为10;0.lmol•L-1NaHSO3溶液的pH约为 5 | HSO3-结合H+的能力SO32-的弱 |
| D | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊 | 碳酸的酸性比苯酚的强 |
| A. | A | B. | B | C. | C | D. | D |