题目内容
【题目】C、Si是构成无机非金属材料的重要元素。
(1)Si在周期表中的位置为_____________。
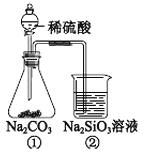
(2)为比较C、Si的非金属性,某同学设计了如下实验:

装置①中盛放的试剂是________,装置②中发生反应的离子方程式是_____________。
(3)SiC是一种重要的高温耐磨材料。SiC中,C元素显________(填“正”或“负”)化合价,从原子结构角度解释原因是__________________。
【答案】
(1)第三周期IVA族;
(2)饱和NaHCO3溶液;CO2+H2O+SiO32-=H2SiO3↓+CO32-;
(3)负;C、Si均位于IVA族,从上到下原子半径逐渐增大,原子核对最外层电子吸引能力逐渐减弱,元素非金属减弱
【解析】
试题分析:(1)Si是14号元素,在周期表中位于第三周期IVA族,故答案为:第三周期IVA族;
(2)要为比较C、Si的非金属性,可以根据最高价氧化物的水化物的酸性强弱比较。装置①生成的二氧化碳中混有少量氯化氢,可以选用饱和NaHCO3溶液除去,装置①中盛放的试剂是饱和NaHCO3溶液,装置②发生反应的离子方程式为CO2 + H2O + SiO32-=H2SiO3↓+ CO32-,故答案为:饱和NaHCO3溶液;CO2 + H2O + SiO32-=H2SiO3↓+ CO32-;
(3)SiC是一种重要的高温耐磨材料。在SiC中,C、Si均位于IVA族,从上到下原子半径逐渐增大,原子核对最外层电子吸引能力逐渐减弱,元素非金属减弱,C的非金属性比硅强,显负化合价,故答案为:C、Si均位于IVA族,从上到下原子半径逐渐增大,原子核对最外层电子吸引能力逐渐减弱,元素非金属减弱。

【题目】不用其他试剂,用最简单的方法鉴别下列物质:
①NaOH溶液,②Mg(NO3)2溶液,③CuSO4溶液,④KCl溶液,正确的鉴别顺序是
A. ①②③④ B. ③④②① C. ④①②③ D. ③①②④
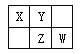
【题目】下表为短周期元素的一部分,请参照元素①~⑧在表中的位置,回答下列问题。
① | ||||||
② | ③ | ④ | ||||
⑤ | ⑥ | ⑦ | ⑧ |
(1)元素⑦在元素周期表位置是________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)。________________________
(3)④、⑤、⑥的离子半径由大到小的顺序为(填元素符号)_______________。
(4)由①和④组成的元素质重比为1:8的化合物的电子式是_________。
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为。______________________________