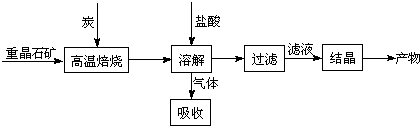
��Ŀ����
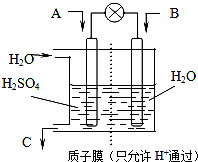 ���ƺ�����CO2��SO2�ǽ������ЧӦ�������������Ч;������ѧ����������ͼ��ʾװ���õ绯ѧԭ��������ת��Ϊ��Ҫ����ԭ�ϣ���ش�
���ƺ�����CO2��SO2�ǽ������ЧӦ�������������Ч;������ѧ����������ͼ��ʾװ���õ绯ѧԭ��������ת��Ϊ��Ҫ����ԭ�ϣ���ش���1����AΪCO2��BΪH2��CΪCH3OH������
��2����AΪSO2��BΪO2��CΪH2SO4������ӦʽΪ
�ʴ�Ϊ��B��CO2+6H++6e-=CH3OH+H2O��
��2��AΪSO2��SԪ�ػ��ϼ���+4�ۣ�BΪO2��OԪ�ػ��ϼ���0�ۣ�CΪH2SO4����Ԫ�ػ��ϼ���-2�ۣ�SԪ�ػ��ϼ���+6���㣬���Զ�������ʧ���ӣ������õ��ӣ���A�Ǹ�����B�������������϶�������ʧ���Ӻ�ˮ��Ӧ�������ᣬ�缫��ӦʽΪ��SO2+2H2O-2e-=4H++SO42-�������������õ��Ӻ������ӷ�Ӧ����ˮ�����Ե�ط�ӦʽΪ��2SO2+O2+2H2O=2H2SO4��C��ÿ����������������ʵ���=10mol��0.1L=1mol��
����Sԭ���غ�֪��ÿ����ͨ����������=
| 1mol��22.4L/mol |
| 1% |
�ʴ�Ϊ��SO2+2H2O-2e-=4H++SO42-��2SO2+O2+2H2O=2H2SO4��2240��

��14�֣�������ЧӦ���Ǹ籾��������仯����о��Ļ�������֮һ��CO2��Ŀǰ�����к�����ߵ�һ���������塣��ˣ����ƺ�����CO2�ǽ��������ЧӦ������Ч;����
��1�� ����һ��;���ǽ�CO2ת�����л���ʵ��̼ѭ�����磺
2CO2(g)��2H2O(l) ="=" C2H4(g)��3O2(g) ��H��+1411.0 kJ/mol
2CO2(g)��3H2O(l) ="=" C2H5OH(1)��3O2(g) ��H��+1366.8 kJ/mol
������ϩˮ�����Ҵ���Ӧ���Ȼ�ѧ����ʽΪ ��
��2����һ�������£�6H2(g) +2CO2(g) CH3CH2OH(g)+3H2O(g)��
CH3CH2OH(g)+3H2O(g)��
| | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
�� �¶�һ��ʱ�������̼��[n(H2)/n(CO2)]��CO2��ת���� ���������С�������䡱����
�� �÷�Ӧ������ӦΪ ��������š����ȷ�Ӧ��
��3��һ�������£���3molH2��1molCO2�����������ڹ̶��ݻ�Ϊ2L���ܱ������У��������·�Ӧ��3H2��g��+ CO2��g��
 CH3OH��g��+ H2O��g����2minĩ�÷�Ӧ�ﵽƽ�⣬���CH3OH��Ũ��Ϊ0.2mol/L�������жϲ���ȷ���� ��
CH3OH��g��+ H2O��g����2minĩ�÷�Ӧ�ﵽƽ�⣬���CH3OH��Ũ��Ϊ0.2mol/L�������жϲ���ȷ���� ��a. �������´˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ
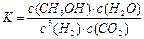
b. H2��ƽ����Ӧ����Ϊ0��3mol/(L��s)
c. CO2��ת����Ϊ60%
d. �����������ܶȲ��ٸı�ʱ���÷�Ӧһ���ﵽƽ��״̬
|
��5��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=2.8��10��9��CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ2��10��4mo1/L �������ɳ�������CaCl2��Һ����СŨ��Ϊ���� ��
CO2��Ŀǰ�����к�����ߵ�һ���������壬���ƺ�����CO2�ǽ������ЧӦ����Ч;����
��1������һ��;���ǽ�CO2ת�����л���ʵ��̼ѭ�����磺
2CO2��g��+2H2O��l��===C2 H4��g��+3O2��g�� ��H=ʮ1411��0kJ/mol
2CO2��g�� +3H2 O��l��=C2 H5OH��1��ʮ3O2��g����H = +1366��8kJ/mol
������ϩˮ�����Ҵ���Ӧ���Ȼ�ѧ����ʽΪ ��
��2����һ�������£�6H2��g��+2CO2��g�� CH3CH2OH��g��+3H2O��g����
CH3CH2OH��g��+3H2O��g����
 �¶ȣ�K�� �¶ȣ�K��CO2ת���ʣ�%�� n��H2��/n��CO2�� | 500 | 600 | 700 | 800 |
| 1��5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
���¶�һ��ʱ�������̼��[�����]��CO2��ת���� ���������С��
�����䡱����
�ڸ÷�Ӧ������ӦΪ ��������š����ȷ�Ӧ��
��3���������£���3 molH2��1molCO2�����������ڹ̶��ݻ�Ϊ2L���ܱ������У��������·�Ӧ��3H2��g��+CO2��g��
 CH3OH��g��+H2O��g����2minĩ�÷�Ӧ�ﵽƽ�⣬���CH30H��Ũ��Ϊ0��2mol��L�������жϲ���ȷ����___ _��
CH3OH��g��+H2O��g����2minĩ�÷�Ӧ�ﵽƽ�⣬���CH30H��Ũ��Ϊ0��2mol��L�������жϲ���ȷ����___ _��a���������´˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ
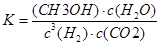
b��H2��ƽ����Ӧ����Ϊ0��3mol����L��s��
c��CO2��ת����Ϊ60%
d�������������ܶȲ��ٸı�ʱ���÷�Ӧһ���ﵽƽ��״̬
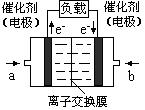
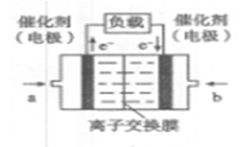
��4����ͼ���Ҵ�ȼ�ϵ�أ��������ҺΪKOH��Һ���Ľṹʾ��ͼ����a��ͨ����� ����Ҵ���������������b���缫�Ϸ����ĵ缫��Ӧ�ǣ� ��
��5��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���
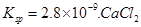 ��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ
��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ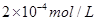 �������ɳ�������CaCl2��Һ����СŨ��Ϊ ��
�������ɳ�������CaCl2��Һ����СŨ��Ϊ �� ������ЧӦ����ȫ���ע�Ļ�������֮һ��CO2��Ŀǰ�����к�����ߵ�һ���������塣��ˣ����ƺ�����CO2�ǽ������ЧӦ����Ч;����
��1������ͬ����CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�ӦCO(g)+H2O(g) CO2(g)+H2(g)���õ������������ݣ�
CO2(g)+H2(g)���õ������������ݣ�
|
ʵ���� |
�¶�/�� |
��ʼ��/mol |
ƽ����/mol |
�ﵽƽ������ʱ��/min |
||
|
CO |
H2O |
H2 |
CO |
|||
|
1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
|
2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
�� ʵ��1������ƽ�ⳣ��K= ������С������λ���֣���
�� ʵ��3�У���ƽ��ʱ��CO��ת���ʴ���ˮ��������a/b ��ֵ �������ֵ��ȡֵ��Χ����
�� ʵ��4����900��ʱ���ڴ������м���10molCO��5molH2O��2molCO2��5molH2�����ʱv(��) v(��)���<������>������=������
��2��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=2.8��10��9��CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ2��10��4mo1/L�������ɳ�������CaCl2��Һ����СŨ��Ϊ ��
��3����֪BaSO4(s) + 4C(s) =4CO(g) + BaS(s) ��H1 =+571.2kJ/mol��
BaSO4(s) + 2C(s) = 2CO2(g) + BaS(s) ��H2=+226.2 kJ/mol��
��ӦC(s) + CO2(g) = 2CO(g)�ġ�H3= kJ/mol��
 ��4��Ѱ������Դ�ǽ������ЧӦ��һ����Ҫ˼·�����������LiFePO4��һ��������������ӵ�أ��ܷ�ӦΪ��FePO4+Li LiFePO4������еĹ������ʿɴ���Li+����õ�طŵ�ʱ������������Ӧʽ�ֱ�Ϊ��
��
�����øõ�ص������ˮ�����ص缫��Ϊ���Ե缫������������������3360mL���壨��״��������ʱ���õ������﮵�����Ϊ
��(Li�����ԭ������ԼΪ7.0)
��4��Ѱ������Դ�ǽ������ЧӦ��һ����Ҫ˼·�����������LiFePO4��һ��������������ӵ�أ��ܷ�ӦΪ��FePO4+Li LiFePO4������еĹ������ʿɴ���Li+����õ�طŵ�ʱ������������Ӧʽ�ֱ�Ϊ��
��
�����øõ�ص������ˮ�����ص缫��Ϊ���Ե缫������������������3360mL���壨��״��������ʱ���õ������﮵�����Ϊ
��(Li�����ԭ������ԼΪ7.0)
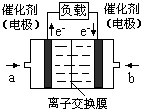 ����������b���缫�Ϸ����ĵ缫��Ӧ�ǣ�
����������b���缫�Ϸ����ĵ缫��Ӧ�ǣ�