题目内容
“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
|
CO |
H2O |
H2 |
CO |
|||
|
1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
|
2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
① 实验1条件下平衡常数K= (保留小数点后二位数字)。
② 实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值 (填具体值或取值范围)。
③ 实验4,若900℃时,在此容器中加入10molCO、5molH2O、2molCO2、5molH2,则此时v(正) v(逆)(填“<”、“>”、“=”)。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为 。
(3)已知BaSO4(s) + 4C(s) =4CO(g) + BaS(s) △H1 =+571.2kJ/mol,
BaSO4(s) + 2C(s) = 2CO2(g) + BaS(s) △H2=+226.2 kJ/mol。
则反应C(s) + CO2(g) = 2CO(g)的△H3= kJ/mol。
 (4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为:
和
。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为
。(Li的相对原子质量约为7.0)
(4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为:
和
。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为
。(Li的相对原子质量约为7.0)
(16分)
(1)①2.67(2分) ②<1 (2分) ③< (2分)
(2)5.6×10—5mo1/L (2分)
(3)+172.5 (2分)
(4)FePO4+Li++e—=LiFePO4(2分) Li-e—=Li+ (2分) 1.4 g(2分)
【解析】
试题分析:(1)①表中实验1有关组分的起始物质的量、平衡物质的量已知,容器体积为2L,由于c=n/V,则
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L) 2 1 0 0
变化浓度(mol/L) 0.8 0.8 0.8 0.8
平衡浓度(mol/L) 1.2 0.2 0.8 0.8
K=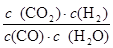 =
=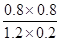 =2.67
=2.67
②实验3中CO、H2O的起始浓度分别为a/2mol/L、b/2mol/L,设CO的变化浓度为xmol/L,由于CO、H2O的变化浓度之比等于化学方程式的系数之比,则H2O的变化浓度为xmol/L,则CO、H2O的平衡转化率分别为2x/a、2x/b,若CO的平衡转化率大于水蒸气,则2x/a>2x/b,所以a/b<1;
③先根据实验2中有关数据求900时的平衡常数,再根据温度不变平衡常数不变,利用此时各组分的物质的量计算各自浓度,根据浓度商与平衡常数的大小判断此时反应进行的方向(若浓度商大于平衡常数,则反应向逆反应方向进行,反之,则向正反应方向进行),最后反应向哪个方向进行,则哪个方向的速率就大于相反方向的速率。
表中实验2有关组分的起始物质的量、平衡物质的量已知,容器体积为2L,由于c=n/V,则
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L) 1 0.5 0 0
变化浓度(mol/L) 0.2 0.2 0.2 0.2
平衡浓度(mol/L) 0.8 0.3 0.2 0.2
K=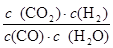 =
=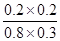 =0.167
=0.167
实验4时CO、H2O、CO2、H2的浓度分别为5mol/L、2.5mol/L、1mol/L、2.5mol/L,则Q=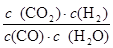 =
=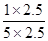 =0.2>K=0.167,说明此时反应应该向逆反应方向进行,所以v(逆)>v(正),即v(正)<v(逆);
=0.2>K=0.167,说明此时反应应该向逆反应方向进行,所以v(逆)>v(正),即v(正)<v(逆);
(2)设混合前CaCl2溶液的最小浓度为xmol/L,Na2CO3溶液的浓度为2×10—4mo1/L,则等体积混合后CaCl2、Na2CO3的浓度分别为x/2mol/L、1×10—4mo1/L,则Ksp=2.8×10—9= x/2×1×10—4,x=5.6×10—5;
(3)先将3个热化学方程式依次编号为①②③,接着观察它们的关系,发现①/2—②/2=③,则C(s) + CO2(g) = 2CO(g)的△H3=△H1 /2—△H2/2=+172.5 kJ/mol;
(4)放电时电池总反应式为FePO4+Li=LiFePO4,其中锂元素由0升为+1价,铁元素由+3降为+2价,前者在负极上发生氧化反应,后者在正极上发生还原反应,根据电子、电荷、原子守恒原理及电解质中定向移动的离子环境,正极反应式为FePO4+Li++e—=LiFePO4,负极反应式为Li-e—=Li+;用惰性电极电解水的原理为2H2O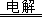 2H2↑+O2↑~4e—,则n(H2)=2n(O2),由于n=V/Vm,则n(H2)+n(O2)=3
n(O2)=3.36L÷22.4L/mol=0.15mol,则n(O2)=0.05mol,则转移电子的物质的量=4 n(O2)=0.2mol,由于新型电池中转移电子和电解水时转移电子相等,FePO4+Li=LiFePO4~e—中参加反应的锂与转移电子的系数之比等于物质的量之比,则参加反应的锂为为0.2mol,由于锂的相对原子质量约为7.0,m=n×M,则参加反应的锂为1.4g。
2H2↑+O2↑~4e—,则n(H2)=2n(O2),由于n=V/Vm,则n(H2)+n(O2)=3
n(O2)=3.36L÷22.4L/mol=0.15mol,则n(O2)=0.05mol,则转移电子的物质的量=4 n(O2)=0.2mol,由于新型电池中转移电子和电解水时转移电子相等,FePO4+Li=LiFePO4~e—中参加反应的锂与转移电子的系数之比等于物质的量之比,则参加反应的锂为为0.2mol,由于锂的相对原子质量约为7.0,m=n×M,则参加反应的锂为1.4g。
考点:考查化学反应原理,涉及求化学平衡常数、比较反应物的平衡转化率、浓度商与平衡常数大小关系、反应进行方向与正、逆反应速率大小的关系、稀释定律、溶度积计算、盖斯定律、原电池和电解原理、电极反应式、物质的量、气体摩尔体积、摩尔质量、物质的量在化学或离子方程式计算中的应用等。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
 zxxk.com
zxxk.com

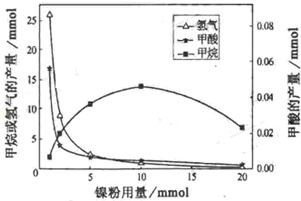
 研究人员根据实验结果得出结论:
研究人员根据实验结果得出结论: