题目内容
5.某同学利用“多米诺骨牌”效应,设计了如图气体制取与性质验证的组合实验,打开A中分液漏斗的活塞,很快看到E中导管口有气泡冒出,且溶液由紫色变红色.请看图回答问题: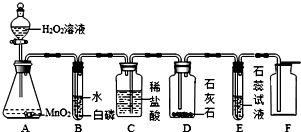
(1)A中反应的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;B中白磷不燃烧,原因是温度没有达到白磷的着火点.
(2)D中看到的现象是C中的稀盐酸被压入D瓶,且瓶中有气泡产生.
(3)用化学方程式表示E中颜色变化的原因CO2+H2O=H2CO3;用F装置收集气体的依据是气体的密度比空气的密度大.
分析 由图可知,打开A中分液漏斗的活塞,过氧化氢分解生成氧气,B中白磷虽与氧气接触,但温度没有达到着火点,C中短导管进气,稀盐酸被压入D中,在D中发生CaCO3+2HCl=CaCl2+CO2↑+H2O,E中发生CO2+H2O=H2CO3,则E中紫色石蕊变红,F为向上排空气法收集二氧化碳,以此来解答.
解答 解:(1)A中反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;B中白磷不燃烧,原因是温度没有达到白磷的着火点,
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;温度没有达到白磷的着火点;
(2)D中看到的现象是C中的稀盐酸被压入D瓶,且瓶中有气泡产生,故答案为:C中的稀盐酸被压入D瓶,且瓶中有气泡产生;
(3)E中发生CO2+H2O=H2CO3,则E中紫色石蕊变红,F为向上排空气法收集二氧化碳,可知气体的密度比空气的密度大,故答案为:CO2+H2O=H2CO3;气体的密度比空气的密度大.
点评 本题考查性质实验方案的设计,为高频考点,把握气体的制备实验、性质实验及实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
相关题目
16.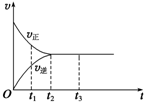 如图是可逆反应X2+3Y2?2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应X2+3Y2?2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
 如图是可逆反应X2+3Y2?2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应X2+3Y2?2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,只有正方向反应 | B. | t2时,反应达到限度 | ||
| C. | t2~t3,反应不再发生 | D. | t2~t3,各物质的浓度相等 |
17.与主族元素在元素周期表中所处位置有关的是( )
| A. | 相对原子质量 | B. | 电子层数和最外层电子数 | ||
| C. | 化合价 | D. | 核内中子数 |
14.能够鉴定氯乙烷中存在氯元素的操作是( )
| A. | 在氯乙烷中直接加入AgNO3溶液 | |
| B. | 在氯乙烷中加蒸馏水,然后加入AgNO3溶液 | |
| C. | 在氯乙烷中加入乙醇,加热后酸化,然后加入AgNO3溶液 | |
| D. | 在氯乙烷中加入NaOH溶液,加热后酸化,然后加入AgNO3溶液 |
15.下列说法正确的是( )
| A. | 用活性炭去除冰箱中的异味是发生了化学反应 | |
| B. | 用热碱水清除炊具上残留的油污,是因为Na2CO3可直接和油污反应 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土保存水果 | |
| D. | 漂白粉在空气中久置变质是因为漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3 |
 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).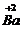 CO3;③三个钙原子3Ca.
CO3;③三个钙原子3Ca.