题目内容
周期表中前20号几种元素,其相关信息如下(铍的原子半径为0.089nm):
F原子中无中子,G在地壳中含量居第二位,H元素焰色反应呈紫色。
请回答下列问题:
(1)B的原子结构示意图为 。
(2)F2C和F2E两种化合物中,沸点较高的是 (填化学式),原因是 。
(3)用电子式表示化合物AF3的形成过程 。
(4)G的单质能与H的最高价氧化物的水化物溶液反应,反应的化学方程式为 。
(5)CE2能使酸性高锰酸钾溶液褪色(有Mn2+生成),写出其反应的离子方程式
。
(6)在2L密闭容器中,一定温度下,能说明反应2AE(g)+E2(g) 2AE2(g)已达到平衡状态的是 (填代号)
2AE2(g)已达到平衡状态的是 (填代号)
a. 2V逆(AE)=V正(E2)
b.容器内压强保持不变
c. 容器内密度保持不变
d. 各组分的物质的量浓度相等
e. 混合气体的平均相对分子质量不再改变
(7)某同学设计了以G同族的短周期元素的最低价氢化物为燃料的电池,电解质溶液含HEF。 则该电池的负极的电极反应式为 。
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.075 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +5,—3 | +3 | +6,—2 | —1 | —2 |
请回答下列问题:
(1)B的原子结构示意图为 。
(2)F2C和F2E两种化合物中,沸点较高的是 (填化学式),原因是 。
(3)用电子式表示化合物AF3的形成过程 。
(4)G的单质能与H的最高价氧化物的水化物溶液反应,反应的化学方程式为 。
(5)CE2能使酸性高锰酸钾溶液褪色(有Mn2+生成),写出其反应的离子方程式
。
(6)在2L密闭容器中,一定温度下,能说明反应2AE(g)+E2(g)
 2AE2(g)已达到平衡状态的是 (填代号)
2AE2(g)已达到平衡状态的是 (填代号)a. 2V逆(AE)=V正(E2)
b.容器内压强保持不变
c. 容器内密度保持不变
d. 各组分的物质的量浓度相等
e. 混合气体的平均相对分子质量不再改变
(7)某同学设计了以G同族的短周期元素的最低价氢化物为燃料的电池,电解质溶液含HEF。 则该电池的负极的电极反应式为 。
(14分)(1) 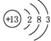 (2分)
(2分)
(2) H2O ;水分子间能形成氢键 (其他合理叙述也可) (各1分)
(3)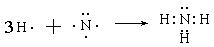 (2分)
(2分)
(4)Si + H2O + 2KOH=K2SiO3 + 2H2↑ (2分)
(5)5SO2 + 2MnO4— + 2H2O=2Mn2+ + 5SO42— + 4H+ (2分)
(6)be (2分) (7)CH4+10OH-―8e-=CO32-+7H2O (2分)
 (2分)
(2分)(2) H2O ;水分子间能形成氢键 (其他合理叙述也可) (各1分)
(3)
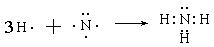 (2分)
(2分)(4)Si + H2O + 2KOH=K2SiO3 + 2H2↑ (2分)
(5)5SO2 + 2MnO4— + 2H2O=2Mn2+ + 5SO42— + 4H+ (2分)
(6)be (2分) (7)CH4+10OH-―8e-=CO32-+7H2O (2分)
试题分析:根据元素的主要化合价和原子半径可知,A是N元素,B是Al元素,C是S属于,D是氯元素,E是氧元素。F原子中无中子,所以F是氢元素。G在地壳中含量居第二位,则G是硅元素。H元素焰色反应呈紫色,则H是K元素。
(1)B的原子结构示意图为
 。
。(2)由于水分子间能形成氢键,所以水分子的沸点高于H2S的沸点。
(3)氨气是含有极性键的共价化合物,其形成过程可表示为
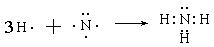 。
。(4)单质硅能和强碱溶液反应,则反应的化学方程式是Si + H2O + 2KOH=K2SiO3 + 2H2↑。
(5)SO2具有还原性,能被酸性高锰酸钾溶液氧化,反应的离子方程式是5SO2 + 2MnO4— + 2H2O=2Mn2+ + 5SO42— + 4H+ 。
(6)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a中反应速率的方向相反,但不能满足反应速率之比是相应的化学计量数之比,所以不能说明;该反应是体积减小的可逆反应,则当压强不再发生变化时可以说明,b正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,c不能说明。平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,d不正确。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以e可以说明,因此答案选be。
(7)原电池中负极失去电子,则甲烷在负极通入电极反应式是CH4+10OH-―8e-=CO32-+7H2O。
点评:本题是高考中的常见题型,试题综合性强,贴近高考,有利于激发学生的学习兴趣和学习积极性。,也有利于培养学生的逻辑推理能力,提高学生的应试能力和学习效率。该题以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目




