题目内容
【题目】中国有广阔的海岸线,建设发展海洋经济、海水的综合利用大有可为。
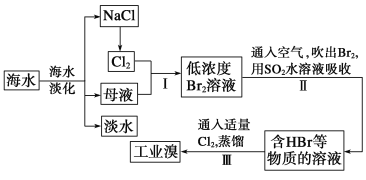
I.空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下图所示,试回答下列问题:
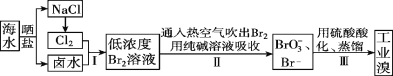
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是________。
(2)步骤②通入热空气或水蒸气吹出Br2,利用了溴的________。
A 氧化性 B 还原性 C 挥发性 D腐蚀性
(3)流程Ⅱ中涉及的离子反应方程式如下,请在下面横线内填入适当的化学计量数:
___Br2+___=___+___Br-+___CO2↑ ________。
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式:________。
(5)流程Ⅲ蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:_________。
Ⅱ.目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
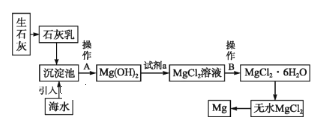
(6)操作A是_________,试剂a是__________。
(7)由无水MgCl2制取Mg的化学方程式是_________。从考虑成本和废物循环利用的角度,副产物可以用于________。
【答案】富集溴元素 C 3Br2+3CO32-═BrO3-+5Br-+3CO2↑ SO2+Br2+2H2O=4H++2Br-+SO42- 温度过高,大量水蒸气随水排出,溴蒸气中水分含量增加,而温度过低,溴不能完全蒸出,降低溴的产率 过滤 盐酸 MgCl2(熔融) ![]() Mg+Cl2↑ 制盐酸(或制取漂白粉,自来水消毒等)
Mg+Cl2↑ 制盐酸(或制取漂白粉,自来水消毒等)
【解析】
I.海水通过晒盐得到氯化钠和卤水,电解饱和氯化钠溶液得到氯气,卤水加入氧化剂氯气氧化溴离子得到低浓度的单质溴溶液,通入热空气或水蒸气吹出Br2,利用的是溴单质的易挥发性,用纯碱溶液吸收溴单质得到含Br-、BrO3-的溶液,再利用溴酸根离子和溴离子在酸性溶液中发生氧化还原反应得到溴单质,据此分析解答。
II.由流程可知,生石灰溶于水生成氢氧化钙,加入海水中沉淀镁离子生成氢氧化镁沉淀,氢氧化镁中加入试剂a得到氯化镁溶液,氯化镁溶液经过蒸发浓缩冷却结晶,得到氯化镁晶体,最后在氯化氢氛围中电解熔融氯化镁得到金属镁,据此分析解答。
(1)步骤Ⅰ中已获得游离态的溴浓度很低,如果直接蒸馏,生产成本较高,不利于工业生产,步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是富集溴元素,降低成本,故答案为:富集溴元素;
(2)溴易挥发,步骤Ⅱ通入热空气或水蒸气吹出Br2,就是利用溴的挥发性,故选C;
(3)该反应中Br元素化合价由0价变为-1价、+5价,其最小公倍数是5,再结合原子守恒或电荷守恒得方程式为3Br2+3CO32-═BrO3-+5Br-+3CO2↑,故答案为:3Br2+3CO32-═BrO3-+5Br-+3CO2↑;
(4)上述流程中吹出的溴蒸气,也可以用二氧化硫水溶液吸收,再用氯气氧化后蒸馏,溴与二氧化硫水溶液反应生成硫酸和溴化氢,反应的化学方程式为:Br2+SO2+2H2O=2HBr+H2SO4,离子方程式为SO2+Br2+2H2O=4H++2Br-+SO42-,故答案为:SO2+Br2+2H2O=4H++2Br-+SO42-;
(5)在溴水中,溴的沸点是58.5°C,水的是100°C,温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低,故答案为:温度过高,大量水蒸气随水排出,溴蒸气中水分含量增加,而温度过低,溴不能完全蒸出,降低溴的产率;
(6)由上述分析可知,操作A是从混合体系中得到氢氧化镁沉淀,为过滤,操作B是蒸发浓缩、冷却结晶,由氢氧化镁转化为氯化镁可知,试剂a为盐酸,故答案为:过滤;盐酸;
(7)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为MgCl2(熔融) ![]() Mg+Cl2↑,从考虑成本和废物循环利用的角度,副产物氯气可以用于制盐酸,氯气可用于水的消毒、制取漂白粉等,故答案为:MgCl2(熔融)
Mg+Cl2↑,从考虑成本和废物循环利用的角度,副产物氯气可以用于制盐酸,氯气可用于水的消毒、制取漂白粉等,故答案为:MgCl2(熔融) ![]() Mg+Cl2↑;制盐酸(或制取漂白粉,自来水消毒等)。
Mg+Cl2↑;制盐酸(或制取漂白粉,自来水消毒等)。

 阅读快车系列答案
阅读快车系列答案