题目内容
【题目】中新社三亚2017年10月8日电,“深海勇士”号载人深潜试验队在中国南海完成“深海勇士”号载人潜水器的全部海上试验任务。Na2O2、KO2都可以作潜水员的供氧剂。

回答下列问题:
(1)KO2中氧元素化合价为_____________。
(2)在过氧化钠与二氧化碳反应中。氧化剂,还原剂的质量之比为________。39g过氧化钠吸收CO2产生氧气体积为_______L(标准状况)。
(3)等物质的量的Na2O2、KO2吸收足量CO2产生O2体积比为_____(同温同压)。
(4)将30g H2、CO的混合气体(平均相对分子质量为15)充入真空密闭容器中,再充入足量氧气,用电火花引燃气体使H2、CO完全反应。将其产物全部通入足量的过氧化钠粉末中、固体质量净增______g,转移电子的个数约为_________。
【答案】![]() 1:1 5.6L 2:3 30 1.204×1024
1:1 5.6L 2:3 30 1.204×1024
【解析】
(1)化合物中化合价代数和为0,钾元素为+1价,KO2中氧元素化合价为0.5价;(2)过氧化钠与二氧化碳反应生成碳酸钠和氧气,方程式为:2Na2O2+2CO2=2Na2CO3+O2,反应中氧化剂与还原剂的物质的量之比为1:1,由方程式,每2molNa2O2参加反应,产生的氧气为1mol,39g过氧化钠的物质的量为![]() =0.5mol,吸收CO2产生氧气体积为
=0.5mol,吸收CO2产生氧气体积为![]() ×22.4L·mol-1=5.6L(标准状况);(3)由2Na2O2+2CO2=2Na2CO3+O2,4KO2+2CO2=2K2O3+3O2可得:等物质的量的Na2O2、KO2吸收足量CO2产生O2体积比为2:3;(4)Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应2CO+O2
×22.4L·mol-1=5.6L(标准状况);(3)由2Na2O2+2CO2=2Na2CO3+O2,4KO2+2CO2=2K2O3+3O2可得:等物质的量的Na2O2、KO2吸收足量CO2产生O2体积比为2:3;(4)Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应2CO+O2![]() 2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2
2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2![]() 2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,固体质量净增质量就是混合气体的质量30g;平均相对分子质量为15,30g H2、CO的混合气体的物质的时为30g/15g·mol-1=2mol,转移电子2mol×2×6.02×1023=1.204×1024。
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,固体质量净增质量就是混合气体的质量30g;平均相对分子质量为15,30g H2、CO的混合气体的物质的时为30g/15g·mol-1=2mol,转移电子2mol×2×6.02×1023=1.204×1024。

【题目】在一个容积不变的密闭容器中,发生反应:2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
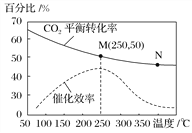
(1)当n(NO):n(O2)=4:1时,O2的转化率随时间的变化关系如下图所示。

①A点的逆反应速率v逆(O2)_____B点的正反应速率v正(O2)(填“大于”、“小于”或“等于” )。
②NO的平衡转化率为______;当达到B点后往容器中再以4:1 加入些NO和 O2,当达到新平衡时,则NO的百分含量 B点NO的百分含量(填“大于”、“小于”或“等于” )。
③到达B点后,下列关系正确的是( )
A.容器内气体颜色不再变化 | B.v正(NO)="2" v正(O2) |
C.气体平均摩尔质量在此条件下达到最大 | D.容器内气体密度不再变化 |
(2)在下图1和图2中出现的所有物质都为气体,分析图1和图2,可推测:4NO(g)+3O2(g)=2N2O5(g) △H= 。


(3)降低温度,NO2(g)将转化为N2O4(g),以N2O4、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,Y为 ,有关石墨I电极反应式可表示为: 。