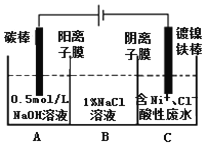
МвДҝДЪИЭ
ЎҫМвДҝЎҝУР»ъРҝКФјБЈЁRЎӘZnBrЈ©УлхЈВИЈЁ![]() Ј©ЕјБӘҝЙУГУЪЦЖұёТ©ОпўтЈә
Ј©ЕјБӘҝЙУГУЪЦЖұёТ©ОпўтЈә

ЈЁ1Ј©»ҜәПОпўсөД·ЦЧУКҪОӘ_____________ЎЈ
ЈЁ2Ј©№ШУЪ»ҜәПОпўтЈ¬ПВБРЛө·ЁХэИ·өДУР______ЈЁЛ«СЎЈ©ЎЈ
AЈ®ҝЙТФ·ўЙъЛ®Ҫв·ҙУҰ |
BЈ®ҝЙУлРВЦЖөДCuЈЁOHЈ©2№ІИИЙъіЙәмЙ«іБөн |
CЈ®ҝЙУлFeCl3ИЬТә·ҙУҰПФЧПЙ« |
DЈ®ҝЙУлИИөДЕЁПхЛбәНЕЁБтЛб»мәПТә·ҙУҰ |
ЈЁ3Ј©»ҜәПОпўуә¬УР3ёцМјФӯЧУЈ¬ЗТҝЙ·ўЙъјУҫЫ·ҙУҰЈ¬°ҙХХНҫҫ¶1әПіЙПЯВ·өДұнКҫ·ҪКҪЈ¬НкіЙНҫҫӯ2ЦРУЙўуөҪўхөДәПіЙВ·ПЯЈә_____________ЈЁұкГч·ҙУҰКФјБЈ¬әцВФ·ҙУҰМхјюЈ©ЎЈ
ЈЁ4Ј©»ҜәПОпўхөДәЛҙЕ№ІХсЗвЖЧЦР·еөДЧйКэОӘ_____________Ј¬ТФHМжҙъ»ҜәПОпўцЦРөДZnBrЈ¬ЛщөГ»ҜәПОпөДфИЛбАаН¬·ЦТм№№Ме№ІУР_____________ЦЦЈЁІ»ҝјВЗКЦРФТм№№Ј©ЎЈ
ЈЁ5Ј©»ҜәПОпўцәНўч·ҙУҰҝЙЦұҪУөГөҪўтЈ¬Фт»ҜәПОпўчөДҪб№№јтКҪОӘЈә_____________ЎЈ
Ўҫҙр°ёЎҝC12H9Br AD CH2=CHCOOH![]() BrCH2CH2COOH
BrCH2CH2COOH![]() BrCH2CH2COOCH2CH3 4 4
BrCH2CH2COOCH2CH3 4 4 ![]()
ЎҫҪвОцЎҝ
ЈЁ1Ј©ёщҫЭ»ҜәПОпўсөДҪб№№јтКҪҝЙРҙіцЖд·ЦЧУКҪОӘC12H9BrЈ»
ЈЁ2Ј©ёщҫЭ»ҜәПОпўтөДҪб№№јтКҪЈ¬Ждә¬УРхҘ»щЈ¬ҝЙ·ўЙъЛ®Ҫв·ҙУҰЈ¬ә¬УРұҪ»·Ј¬·ўЙъұҪ»·ЙПөДПх»Ҝ·ҙУҰЈ¬Г»УРИ©»щЈ¬І»ҝЙУлРВЦЖөДCuЈЁOHЈ©2№ІИИЙъіЙәмЙ«іБөнЈ¬Г»УР·УфЗ»щЈ¬І»ҝЙУлFeCl3ИЬТә·ҙУҰПФЧПЙ«Ј¬ЛщТФAЎўDХэИ·Ј¬СЎФсADЈ»
ЈЁ3Ј©ёщҫЭўцөДҪб№№јтКҪј°Нҫҫ¶ўсөДРЕПўЈ¬ҝЙНЖіцўхөДҪб№№јтКҪОӘBrCH2CH2COOCH2CH3Ј¬ҙУ¶шҝЙЦӘўхКЗУЙўфУлТТҙј·ўЙъхҘ»Ҝ·ҙУҰөГөҪЈ¬ҝЙНЖіцўфөДҪб№№јтКҪОӘBrCH2CH2COOHЈ¬¶ш»ҜәПОпўуә¬УР3ёцМјФӯЧУЈ¬ЗТҝЙ·ўЙъјУҫЫ·ҙУҰЈ¬ҙУ¶шҝЙЦӘ»ҜәПОпўуөДҪб№№јтКҪОӘCH2=CHCOOHЈ¬№КәПіЙВ·ПЯҝЙұнКҫОӘЈәCH2=CHCOOH![]() BrCH2CH2COOH
BrCH2CH2COOH![]() BrCH2CH2COOCH2CH3Ј»
BrCH2CH2COOCH2CH3Ј»
ЈЁ4Ј©»ҜәПОпўхөДҪб№№ОӘBrCH2CH2COOCH2CH3Ј¬ГҝёцМјФӯЧУЙПөДЗв¶јПаН¬Ј¬І»Н¬МјФӯЧУЙПөДHФӯЧУІ»ПаН¬Ј¬ЛщТФУҰУР4Чй·еЈ»ТФЗвФӯЧУHМжҙъ»ҜәПОпўцЦРөДZnBrЈ¬ЛщөГ»ҜәПОпөДҪб№№јтКҪОӘCH3CH2COOCH2CH3Ј¬ЖдКфУЪфИЛбАаөДҪб№№УҰОӘC4H9COOHЈ¬C4H9ЎӘОӘ¶Ў»щЈ¬¶Ў»щУР4ЦЦІ»Н¬өДҪб№№өДHФӯЧУЈ¬ЛщТФC4H9COOHөДН¬·ЦТм№№Ме№ІУР4ЦЦЈ»
ЈЁ5Ј©ёщҫЭМвДҝРЕПўЈ¬УР»ъРҝКФјБЈЁRЎӘZnBrЈ©УлхЈВИЈЁ![]() Ј©ЕјБӘҝЙУГУЪЦЖұёТ©ОпўтЈ¬ТтҙЛ»ҜәПОпўцОӘBrZnCH2CH2COOCH2CH3Ј¬ФтТӘәПіЙўтЈ¬ўчОӘхЈВИЈ¬ёщҫЭўтөДҪб№№ј°Нҫҫ¶ўсәПіЙ»ҜәПОпТ©ОпўтөД·ҪКҪЈ¬ҝЙНЖЦӘўчөДҪб№№ОӘ
Ј©ЕјБӘҝЙУГУЪЦЖұёТ©ОпўтЈ¬ТтҙЛ»ҜәПОпўцОӘBrZnCH2CH2COOCH2CH3Ј¬ФтТӘәПіЙўтЈ¬ўчОӘхЈВИЈ¬ёщҫЭўтөДҪб№№ј°Нҫҫ¶ўсәПіЙ»ҜәПОпТ©ОпўтөД·ҪКҪЈ¬ҝЙНЖЦӘўчөДҪб№№ОӘ![]() ЎЈ
ЎЈ

 ЦЗ»ЫРЎёҙП°ПөБРҙр°ё
ЦЗ»ЫРЎёҙП°ПөБРҙр°ёЎҫМвДҝЎҝIЈ®јЧИ©ФЪДҫІДјУ№ӨЎўТҪТ©өИ·ҪГжУРЦШТӘУГНҫЎЈјЧҙјЦұҪУНСЗвКЗ№ӨТөЙПәПіЙјЧИ©өДРВ·Ҫ·ЁЈ¬ЦЖұё№эіМЙжј°өДЦчТӘ·ҙУҰИзПВЈә
·ҙУҰIЈәCH3OH(g)![]() HCHO(g)+H2(g) ҰӨH1=+85.2kJ/mol
HCHO(g)+H2(g) ҰӨH1=+85.2kJ/mol
·ҙУҰIIЈәCH3OH(g)+![]() O2(g)
O2(g)![]() HCHO(g)+H2O(g) ҰӨH2
HCHO(g)+H2O(g) ҰӨH2
·ҙУҰIIIЈә2H2(g)+O2(g)![]() 2H2O(g) ҰӨH3=ЎӘ483.6kJ/mol
2H2O(g) ҰӨH3=ЎӘ483.6kJ/mol
ЈЁ1Ј©јЖЛг·ҙУҰўтөД·ҙУҰИИҰӨH2=__________________ЎЈ
ЈЁ2Ј©јЎИвЦРөДјЎәмө°°Ч(Mb)ҝЙУлO2ҪбәПЙъіЙMbO2ЈәMb(aq)+O2(g)![]() MbO2(aq)Ј¬ЖдЦРkХэәНkДж·ЦұрұнКҫХэ·ҙУҰәНДж·ҙУҰөДЛЩВКіЈКэЈ¬јҙҰФХэ=kХэЎӨc(Mb)ЎӨP(O2)Ј¬ҰФДж=kДжЎӨc(MbO2)ЎЈ37ЎжКұІвөГјЎәмө°°ЧөДҪбәП¶И(ҰБ)УлP(O2)өД№ШПөИзПВұн[ҪбәП¶И(ҰБ)ЦёТСУлO2ҪбәПөДјЎәмө°°ЧХјЧЬјЎәмө°°ЧөД°Щ·ЦұИ]Јә
MbO2(aq)Ј¬ЖдЦРkХэәНkДж·ЦұрұнКҫХэ·ҙУҰәНДж·ҙУҰөДЛЩВКіЈКэЈ¬јҙҰФХэ=kХэЎӨc(Mb)ЎӨP(O2)Ј¬ҰФДж=kДжЎӨc(MbO2)ЎЈ37ЎжКұІвөГјЎәмө°°ЧөДҪбәП¶И(ҰБ)УлP(O2)өД№ШПөИзПВұн[ҪбәП¶И(ҰБ)ЦёТСУлO2ҪбәПөДјЎәмө°°ЧХјЧЬјЎәмө°°ЧөД°Щ·ЦұИ]Јә
ўЩјЖЛг37ЎжЎўP(O2)ОӘ2.00kPaКұЈ¬ЙПКц·ҙУҰөДЖҪәвіЈКэK=_______ЎЈ
P(O2) | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5Ј®00 | 6.00 |
ҰБЈЁMbO2%Ј© | 50.0 | 67.0 | 80.0 | 85.0 | 88.0 | 90.3 | 91.0 |
ўЪөјіцЖҪәвКұјЎәмө°°ЧУлO2өДҪбәП¶И(ҰБ)УлO2өДС№Зҝ[P(O2)]Ц®јдөД№ШПөКҪҰБ=_______(УГә¬УРkХэЎўkДжөДКҪЧУұнКҫ)ЎЈ
IIЈ®CO2јИКЗОВКТЖшМеЈ¬ТІКЗЦШТӘөД»Ҝ№ӨФӯБПЈ¬ТФCO2ОӘФӯБПҝЙәПіЙ¶аЦЦУР»ъОпЎЈ
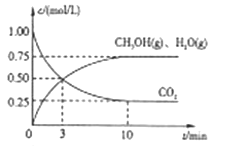
ЈЁ3Ј©CO2УГУЪЙъІъТТП©Ј¬ТСЦӘЈә2CO2(g)+6H2(g)![]() CH2=CH2(g) + 4H2O(g) ҰӨHЈҪQkJ/molЎЈТ»¶ЁМхјюПВЈ¬ °ҙІ»Н¬өДН¶БПұИX[XЈҪ
CH2=CH2(g) + 4H2O(g) ҰӨHЈҪQkJ/molЎЈТ»¶ЁМхјюПВЈ¬ °ҙІ»Н¬өДН¶БПұИX[XЈҪ![]() ]ПтДіИЭ»эҝЙұдөДәгС№ГЬұХИЭЖчЦРідИлCO2ЎўH2Ј¬ІвөГІ»Н¬Н¶БПұИКұCO2өДЧӘ»ҜВКУлОВ¶ИөД№ШПөИзНјЛщКҫЎЈ
]ПтДіИЭ»эҝЙұдөДәгС№ГЬұХИЭЖчЦРідИлCO2ЎўH2Ј¬ІвөГІ»Н¬Н¶БПұИКұCO2өДЧӘ»ҜВКУлОВ¶ИөД№ШПөИзНјЛщКҫЎЈ

ўЩX1______X2ЈЁМоЎ°ЈҫЎұ»тЎ°ЈјЎұЈ¬әуН¬Ј©Ј¬Q______0ЎЈ
ўЪНјЦРAЎўBЎўCИэөг¶ФУҰөДЖҪәвіЈКэKAЎўKBЎўKCөДҙуРЎ№ШПөОӘ______ЎЈ
ЈЁ4Ј©іЈОВПВЈ¬УГNaOHИЬТәЧчCO2І¶ЧҪјБІ»ҪцҝЙТФҪөөНМјЕЕ·ЕЈ¬¶шЗТҝЙөГөҪЦШТӘөД»Ҝ№ӨІъЖ·Na2CO3әНNaHCO3ЎЈ
ўЩТСЦӘ25ЎжКұ0.1mol / LөДNaHCO3ИЬТәөДpH=8.3Ј¬КФНЁ№эјЖЛгИ·¶ЁИЬТәЦРёчАлЧУЕЁ¶ИУЙҙуөҪРЎөДЛіРтОӘ_____[ТСЦӘЈәіЈОВПВH2CO3өДөзАліЈКэKa1= 4.4ЎБ107ЎўKa2 = 5ЎБ1011 ]ЎЈ
ўЪУыУГ5LNa2CO3ИЬТәҪ«23.3gBaSO4№ММеИ«¶јЧӘ»ҜОӘBaCO3Ј¬ФтЛщУГөДNa2CO3ИЬТәөДОпЦКөДБҝЕЁ¶ИЦБЙЩОӘ____ЎЈ
[ТСЦӘЈәіЈОВПВKsp(BaSO4)=1ЎБ107ЎўKsp(BaCO3)=2.5ЎБ106 ]ЎЈ(әцВФИЬТәМе»эөДұд»Ҝ)