题目内容
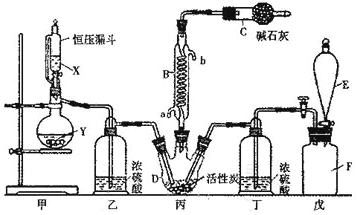
【题目】环戊二烯基铁[ Fe(C5H5)2]是一种有机过渡金属化合物,常温下为橙黄色粉末,难溶于水,易溶于有机溶剂,温度超过100 °C能够升华,实验室制备环戊二烯基铁的装置和步骤如下:
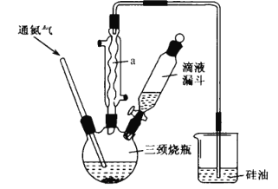
实验步骤:
步骤1:在三颈烧瓶中加入10mL乙二醇二甲醚(作溶剂)和4. 5 g研细的 KOH 粉末,通入氮气并开启磁力搅拌器 ,然后加入1. 5mL环戊二烯(过量);
步骤2:将1.5g FeCl24H2O溶于5 mL二甲基亚砜中 ,并转入滴液漏斗中,将步骤1中的混合物猛烈搅拌10 min,打开滴液漏斗将氯化亚铁的二甲基亚砜溶液在45 min钟左右滴完;
步骤3:关闭滴液漏斗,在氮气保护下继续搅拌30 min;
步骤4:将反应后的混合液倒入100 m L烧杯内,加入少量盐酸除去剩余的KOH,再加入20mL 水,继续搅拌悬浊液15min,抽滤产物,并用水洗涤产物3~4次,最后将产物铺在面皿上,置于真空干燥器内干燥。回答下列问题:
(1)仪器a的作用是___________________。
(2)制备过程中若不通入氮气,会降低环戊二烯基铁的产率,试分析其中的原因: __________。
(3)硅油的主要作用是______。
(4)步骤4中分离环戊二烯基铁也可采用如下方法,请将分离步骤补充完整:向反应后的混合液加入10 mL乙醚(ρ= 0.71g cm-3 ) 充分搅拌,然后转入_____(填仪器名称)中,依次用盐酸、水各洗涤两次,待液体分层后_____________(填完整操作过程),将含有二环戊二烯基合铁的溶液在通风橱中蒸发得到二环戊二烯基合铁粗产品。
(5)可采用如图所示的简易装置分离提纯环戊二烯基铁。将颗粒状环戊二烯基铁放入蒸发皿中并小火加热,环戊二烯基铁在扎有小孔的滤纸上凝结,该分离提纯方法的名称是_______________,装置棉花的作用是___________。

(6)若最终制得环戊二烯基铁质量为 0.16g,则产率为_____%(保留一位小数)。
【答案】冷凝回流有机物提高原料利用率 部分Fe2+ 被空气中的氧气氧化,降低了参加反应的Fe2+ 的量 液封,防止空气中的氧气进入三颈烧瓶中,吸收挥发出来的有机物 分液漏斗 先将水层从分液漏斗下口放出,再将环戊二烯基铁的乙醚溶液从上口倒出 升华 防止环戊二烯基铁挥发进入空气中,减缓与空气的对流 11.4
【解析】
由题中信息可知,过量的环戊二烯和1.5g FeCl24H2O在碱性条件下、适当的有机溶剂中可以发生反应制得环戊二烯基铁。Fe2+具有较强的还原性,易被空气中的氧气氧化。故反应过程中要持续通入氮气。为防止空气中的氧气进入三颈烧瓶中,并吸收挥发出来的有机物,连接冷凝管的玻璃管要用硅油液封。计算产率时,要以不过量的氯化亚铁晶体为基准计算出理论产量。
(1)仪器a为球形冷凝管,其作用是冷凝回流有机物,提高原料利用率。
(2)Fe2+具有较强的还原性,易被空气中的氧气氧化。制备过程中若不通入氮气,会降低二环戊二烯基合铁的产率,其中的原因是:部分Fe2+被空气中的氧气氧化,降低了参加反应的Fe2+的量 。
(3)从冷凝管中挥发出的有机物会污染空气,若有氧气从冷凝管进入系统会降低二环戊二烯基合铁的产率,因此,硅油的主要作用是:液封,防止空气中的氧气进入三颈烧瓶中,吸收挥发出来的有机物。
(4)环戊二烯基铁[ Fe(C5H5)2]难溶于水,易溶于有机溶剂。因此,步骤4中分离环戊二烯基铁也可采用如下方法:向反应后的混合液加入10 mL乙醚(ρ= 0.71g cm-3) 充分搅拌,然后转入分液漏斗中,依次用盐酸、水各洗涤两次。乙醚的密度比水小,待液体分层后,上层为有机层,下层为水层。先将水层从分液漏斗下口放出,再将环戊二烯基铁的乙醚溶液从上口倒出,将含有环戊二烯基铁的溶液在通风橱中蒸发得到环戊二烯基铁粗产品。
(5)环戊二烯基铁在温度超过100 °C时能够升华。将颗粒状环戊二烯基铁放入蒸发皿中并小火加热,环戊二烯基铁在扎有小孔的滤纸上凝结,该分离提纯方法的名称是升华,装置棉花的作用是防止环戊二烯基铁挥发进入空气中,减缓与空气的对流。
(6)环戊二烯是过量的,1.5g FeCl24H2O的物质的量为,![]() ,则理论上可以制得二环戊二烯基合铁的物质的量为
,则理论上可以制得二环戊二烯基合铁的物质的量为![]() ,质量为1.40g。若最终制得环戊二烯基铁质量为 0.16g,则产率为
,质量为1.40g。若最终制得环戊二烯基铁质量为 0.16g,则产率为![]() 11.4%。
11.4%。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案