题目内容
【题目】下列有关实验存在不合理的装置是




A.装置甲:用CCl4萃取碘水中的碘
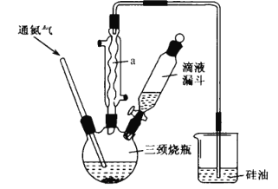
B.装置乙:加热碘的CCl4溶液,分离碘并回收CCl4
C.装置丙:验证硫酸、碳酸、苯酚溶液的酸性
D.用乙酸、乙醇制取乙酸乙酯
【答案】BD
【解析】
A.碳易溶于CCl4、不易溶于水,且CCl4不溶于水,用CCl4萃取碘水中的碘,所用装置甲合理,A不符合题意;
B.加热碘的CCl4溶液,分离碘并回收CCl4,所用的蒸馏装置乙中温度计的使用不合理,温度计的水银球要位于支管口附近,B符合题意;
C.硫酸与碳酸钠反应生成气体,说明硫酸的酸性强于碳酸;该气体通入苯酚钠溶液中出现浑浊,说明碳酸的酸性强于苯酚。用装置丙验证硫酸、碳酸、苯酚溶液的酸性,合理,C不符合题意;
D. 用乙酸、乙醇制取乙酸乙酯,所用收集乙酸乙酯的试管中的试剂不合理,乙酸乙酯易在氢氧化钠溶液中发生水解,D符合题意。
故选BD。

练习册系列答案
相关题目