题目内容
【题目】铝元素含量居金属首位,主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领城应用广泛。
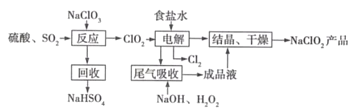
Ⅰ.工业上用铝土矿制备铝的某种化合物的工艺流程如图:

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:___Fe2++___ClO-+___=___Fe(OH)3↓+___C1-+___
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为___(选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、___(填操作名称)、过滤、洗涤。
Ⅱ.铵明矾(NH4Al(SO4)212H2O)是常见的食品添加剂,在日常生活、生产中也占有一席之地。
(1)铵明矾可用于净水,用离子方程式表示其净水原理___;向其溶液中逐滴加入NaOH溶液至过量,可观察到的现象是___。
(2)实验证明铵明矾高温分解后气体的组成成份是NH3、N2、SO3、SO2和H2O,且相同条件下测得生成N2和SO2的体积比是定值,V(N2):V(SO2)=___。
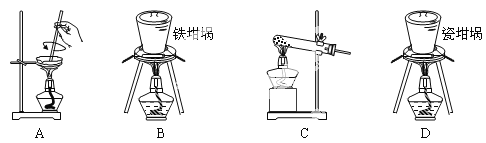
(3)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为___(填代号)。
【答案】2 1 5H2O 2 1 4H+ C 冷却结晶,过滤 铵明矾溶液电离出的铝离子水解得到氢氧化铝胶体,可以吸附悬浮物质,可以用于净水 先产生白色沉淀,后产生有刺激性气味的气体,再加入过量的NaOH溶液,白色沉淀逐渐溶解并消失 1:3 B
【解析】
Ⅰ.图示工艺流程为:铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)加入稀盐酸,得到滤渣为二氧化硫,滤液中含有铁离子、亚铁离子和氯离子;加入漂白液后亚铁离子氧化成铁离子,铁离子水解生成氢氧化铁沉淀;滤液B为氯化铝溶液;二氧化硫与氢氧化钠在铁坩埚中焙烧生成硅酸钠,
(1)①依据流程分析,滤液中含有氯化铁、氯化亚铁、氯化铝,在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性,次氯酸根离子具有氧化性氧化亚铁离子为铁离子在溶液中形成氢氧化铁沉淀除去;依据氧化还原反应电子守恒和原子守恒配平计算写出;
②滤液B中铝元素为氯化铝,依据氢氧化铝溶液强酸强碱,不溶于弱碱选择;
加入浓盐酸抑制氯化铝的水解,蒸发浓缩冷却结晶,过滤洗涤;
Ⅱ.(1)铵明矾溶液中铝离子水解,溶液呈酸性,得到氢氧化铝胶体,可以用于净水;向溶液中加入氢氧化钠溶液,首先与溶液中铝离子反应生成氢氧化铝沉淀,再与氨气根离子反应生成氨气,再加入过量的NaOH溶液溶解氢氧化铝;
(2)根据电子转移守恒确定n(N2):n(SO2),相同条件下气体体积之比等于其物质的量之比.
(3)A.蒸发皿中含有二氧化硅和氢氧化钠反应;
B.铁坩埚可以熔融二氧化硅和氢氧化钠;
C.玻璃中含二氧化硅和氢氧化钠反应;
D.瓷坩埚含有二氧化硅和氢氧化钠反应。
Ⅰ. (1)①滤液中含有氯化铁、氯化亚铁、氯化铝,在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性,次氯酸根离子具有氧化性,氧化亚铁离子为铁离子,在溶液中形成氢氧化铁沉淀除去;次氯酸根离子被还原为氯离子,反应的离子方程式为2Fe2++ClO+5H2O=2Fe(OH)3↓+C1+4H+;
故答案为:2;1;5H2O;2;1;4H+;
②滤液中含有的是氯化铝溶液,将滤液B中的铝元素以沉淀形式析出,
A.氢氧化钠溶液可以沉淀铝离子但过了会溶解氢氧化铝,氢氧化钠不是最佳试剂,故A错误;
B.硫酸溶液不与铝离子反应,故B错误;
C.氨水是弱碱不能溶解氢氧化铝,过量的氨水和铝离子形成氢氧化铝沉淀过滤得到氢氧化铝固体,故C正确;
D.二氧化碳和氯化铝不反应,无法生成氢氧化铝沉淀,故D错误;
故答案为:C;
③加入浓盐酸抑制氯化铝的水解,蒸发浓缩,冷却结晶,过滤,洗涤,
故答案为:冷却结晶,过滤;
Ⅱ. (1)铵明矾溶液中铝离子水解得到氢氧化铝胶体,可以吸附悬浮物质,可以用于净水;向溶液中加入氢氧化钠溶液,首先与溶液中铝离子反应生成氢氧化铝沉淀,再与氨气根离子反应生成氨气,再加入过量的NaOH溶液溶解氢氧化铝,现象为:先产生白色沉淀,后产生有刺激性气味的气体,再加入过量的NaOH溶液,白色沉淀逐渐溶解并消失,
故答案为:铵明矾溶液电离出的铝离子水解生成氢氧化铝胶体,有吸附作用,故铵明矾能净水;先产生白色沉淀,后产生有刺激性气味的气体,再加入过量的NaOH溶液,白色沉淀逐渐溶解并消失;
(2)根据电子转移守恒:2×[0(3)]×n(N2)=n(SO2)×(64),故n(N2):n(SO2)=1:3,相同条件下气体体积之比等于其物质的量之比,故V(N2):V(SO2)=1:3,
故答案为:1:3.
(3)A.蒸发皿中含有二氧化硅和氢氧化钠反应,不能用于SiO2和NaOH焙烧制备硅酸钠,故A错误;
B. 铁坩埚可以熔融二氧化硅和氢氧化钠,可在铁坩埚中用SiO2和NaOH焙烧制备硅酸钠,故B正确;
C. 玻璃中含二氧化硅和氢氧化钠反应,不能用于SiO2和NaOH焙烧制备硅酸钠,故C错误;
D. 瓷坩埚含有二氧化硅和氢氧化钠反应,不能用于SiO2和NaOH焙烧制备硅酸钠,故D错误;
故答案为:B。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】在2 L密闭容器内,800 ℃时,0.02molNO(g)和0.01molO2(g)反应生成NO2(g)的体系中,n(NO)随时间的变化如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应_____(填“是”或“不是”)可逆反应,在第5 s时,NO的转化率为_______。
(2)如图中表示NO2变化曲线的是________,用O2表示从0~2 s内该反应的平均速率v=________。
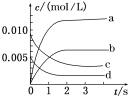
(3)能说明该反应已达到平衡状态的是________。
a v(NO2)=2v(O2) b 容器内压强保持不变
c v逆(NO)=2v正(O2) d 容器内密度保持不变