题目内容
下列离子方程式,正确的是
| A.氢氧化铁与盐酸反应:H++OH-=H2O |
| B.CaCO3溶于稀盐酸中:CO32-+2H+=CO2↑+H2O |
| C.铁与H2SO4反应:Fe+2H+=Fe3++H2↑ |
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO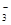 +Ca2++OH-= CaCO3↓+H2O +Ca2++OH-= CaCO3↓+H2O |
D
解析试题分析:氢氧化铁与盐酸反应反应生成氯化铁和水,离子反应为Fe(OH)3+3H+═Fe3++3H2O,故A错误;CaCO3溶于稀盐酸中反应的离子方程式为:CaCO3+2H+═Ca2++CO2↑+H2O,故B错误;铁与H2SO4反应的离子方程式为:Fe+2H+=Fe2++H2↑,故C错误;Ca(HCO3)2溶液与少量NaOH溶液反应:HCO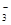 +Ca2++OH-= CaCO3↓+H2O,故D正确。
+Ca2++OH-= CaCO3↓+H2O,故D正确。
考点:离子反应方程式的书写。

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
下列物质水溶液能导电,但该物质属于非电解质的是
| A.Na2O | B.Cl2 | C.H2SO4 | D.SO2 |
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件下关于离子存在的说法中正确的是( )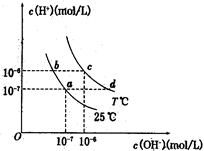
| A.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Fe2+ |
B.b点对应的溶液中大量存在: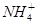 、K+、Cl-、 、K+、Cl-、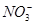 |
| C.d点对应的溶液中大量存在:Al3+、K+、ClO-、Cl- |
D.a点对应的溶液中大量存在: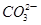 、Na+、Cl-、 、Na+、Cl-、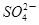 |
下列是某同学对相应反应的离子方程式和评价,其中都合理的是 ( )
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | 碳酸钙与醋酸反应 | CO32-+2CH3COOH=2CH3COO-+H2O+CO2↑ | 错误,碳酸钙是弱电解质,不应写成离子形式 |
| B | 氢氧化钠溶液中通入过量CO2 | OH-+CO2=HCO3- | 错误,通入过量CO2应生成CO32- |
| C | 硫酸亚铁溶液中加过氧化氢溶液 | Fe2++2H2O2+4H+=Fe3++4H2O | 正确 |
| D | 过量氢氧化钙溶液与碳酸氢镁溶液反应: | 2Ca2++4OH-+Mg2++2HCO3-=Mg(OH)2↓+2CaCO3↓+2H2O | 正确 |
下列各组离子能在溶液中大量共存的是
| A.K+、H+、SO42-、OH- | B.Na+、Ca2+、CO32-、NO3- |
| C.Na+、H+、C1-、CO32- | D.Na+、Cu2+、C1-、SO42- |
有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验,从实验可以判断:
| A.该固体粉末中一定不含有BaCl2 |
| B.该固体粉末中一定含有KNO3 |
| C.它的组成可能是CaCO3、BaCl2、CuSO4 |
| D.它的组成一定是CaCO3、Na2SO4、KNO3 |
下列反应的离子方程式中,正确的是( )
| A.稀硫酸滴在银片上:2Ag+2H+=2Ag++H2↑ |
| B.稀硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-= H2O +BaSO4↓ |
| C.稀硝酸滴在大理石上:CaCO3+2H+=Ca2++H2CO3 |
| D.氧化铁与稀盐酸混合:Fe2O3+6H+=2Fe3++3H2O |
下列各组离子中可能大量共存的是
| A.在能使紫色石蕊试剂变红的溶液中:Na+、SO42-、Cl-、HCO3- |
| B.在强酸性溶液中:NH4+、Ba2+、Fe2+、Br-、NO3- |
| C.在含有大量AlO2-的溶液中:NH4+、Na+、Cl-、Al3+ |
| D.在水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、K+、CO32-、NO3- |
下列离子方程式正确的是( )
| A.向AlCl3溶液中滴加氨水:Al3++3OH-=Al(OH)3↓ |
| B.向NaHCO3溶液中加入少量Ca(OH)2溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O |
C.向苯酚溶液中滴加Na2CO3溶液: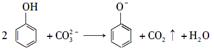 |
| D.向氯化亚铁溶液中滴加稀硝酸:3Fe2++4H++ NO3-=3Fe3++NO↑+2H2O |