题目内容
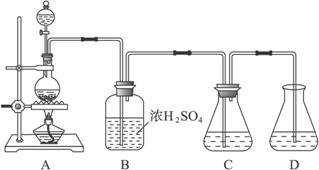
实验室可用碳酸钠制备少量亚硫酸钠晶体,有关装置如下图所示:
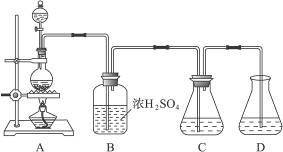
将17 g Na2CO3溶于80 mL水中,分装在C、D两个锥形瓶中,再将25 g铜屑放入圆底烧瓶中,将60 mL浓H2SO4和10 mL水的混合液装在分液漏斗中,逐滴加入硫酸后,小心加热使SO2逐渐产生(注意控制气量大小和反应速率的快慢)。将SO2通入Na2CO3溶液中至饱和,在合并C、D两瓶所得溶液中,慢慢加入17 g Na2CO3,蒸发浓缩,冷却后得亚硫酸钠晶体。试回答:
(1)如何配制60 mL浓H2SO4与10 mL水的混合液?
(2)装置B中浓H2SO4的作用:______________________________________________________;
(3)Na2SO3溶液要分装在两个锥形瓶中的理由是__________________;写出C中发生反应的离子方程式__________________;
(4)控制SO2产生速度的方法是_____________________________________________;
(5)通SO2结束后,加Na2CO3的目的是____________________________________。
(1)取10 mL蒸馏水放在烧杯中,沿烧杯壁将60 mL浓H2SO4缓缓注入水中,同时不断搅拌。
(2)干燥,且可根据放出气体的快慢程度判断SO2的生成速度
(3)充分吸收SO2 2SO2+![]() +H2O====CO2↑+
+H2O====CO2↑+![]()
(4)观察B中出现气体的快慢,通过加热控制反应速度,当B中气体放出过快,可移去酒精灯,待缓和后再用小火加热
(5)使NaHSO3转化为Na2SO3
解析:
浓H2SO4为氧化性酸,与Cu反应生成SO2,SO2的水溶液为H2SO3,H2SO3的酸性比H2CO3强,SO2与Na2CO3溶液作用可产生Na2SO3和CO2,其反应方程式分别为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O,SO2+Na2CO3====Na2SO3+CO2↑。
CuSO4+SO2↑+2H2O,SO2+Na2CO3====Na2SO3+CO2↑。

 亚铁盐在空气中易被氧化,但形成复盐可稳定存在.硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,商品名为摩尔盐,易溶于水,不溶于乙醇. 通常可用如下步骤在实验室中少量制备:
亚铁盐在空气中易被氧化,但形成复盐可稳定存在.硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,商品名为摩尔盐,易溶于水,不溶于乙醇. 通常可用如下步骤在实验室中少量制备: 化学反应在工农业生产中有着重要的应用.按要求回答下列问题:
化学反应在工农业生产中有着重要的应用.按要求回答下列问题: