题目内容
 化学反应在工农业生产中有着重要的应用.按要求回答下列问题:
化学反应在工农业生产中有着重要的应用.按要求回答下列问题:(1)利用化学反应可以制备许多物质.
①实验室用铜制备NO的离子方程式为
②可用Al和Fe2O3制Fe,该反应的化学方程式为
③海水提溴过程中,向浓缩的海水中通入氯气,再用热空气吹出生成的溴,然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-.这两步反应的离子方程式分别为
(2)化学反应能为人类生产生活提供能源.
①由反应CH4+2O2
| ||
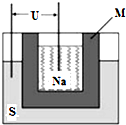
②2011年山东高考化学中曾提到钠硫高能电池,如图是该电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS=Na2Sx.该电池负极为
分析:(1)①金属铜可以和稀硝酸之间反应生成硝酸铜、一氧化氮和水;
②金属铝可以和氧化铁在高温下反应生成金属铁和氧化铝;
③氯气具有氧化性,能将溴离子氧化为溴单质,溴水可以和碱性碳酸钠之间反应得到溴化钠、溴酸钠和二氧化碳气体;
(2)①燃料电池中燃料失电子的电极是负极,正极上氧气得电子发生还原反应,据此回答;
②原电池正极发生得电子的还原反应,负极上发生失电子的氧化反应.
②金属铝可以和氧化铁在高温下反应生成金属铁和氧化铝;
③氯气具有氧化性,能将溴离子氧化为溴单质,溴水可以和碱性碳酸钠之间反应得到溴化钠、溴酸钠和二氧化碳气体;
(2)①燃料电池中燃料失电子的电极是负极,正极上氧气得电子发生还原反应,据此回答;
②原电池正极发生得电子的还原反应,负极上发生失电子的氧化反应.
解答:解:(1)①实验室用铜制备NO的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
②金属铝可以和氧化铁在高温下反应生成金属铁和氧化铝,该反应为铝热反应,可以生产铁,即2Al+Fe2O3
2Fe+Al2O3,故答案为:2Al+Fe2O3
2Fe+Al2O3;
③氯气具有氧化性,能将溴离子氧化为溴单质,2Br-+Cl2=2Cl-+Br2,溴水可以和碱性碳酸钠之间反应得到溴化钠、溴酸钠和二氧化碳气体,实质是:3Br2+3CO32-=5Br-+BrO3-+3CO2↑,故答案为:2Br-+Cl2=2Cl-+Br2,3Br2+3CO32-=5Br-+BrO3-+3CO2↑;
(2)①燃料电池中燃料甲烷失电子的电极是负极,电极反应为:CH4+10OH--8e-=CO32-+7H2O,故答案为:CH4+10OH--8e-=CO32-+7H2O;
②根据电池反应为2Na+xS=Na2Sx,失电子的是金属钠,所以Na是负极,Na-e-=Na+,在正极上是S得电子得到硫离子的过程,即xS+2e-=Sx2-,用该电池作电源进行粗铜精炼时,阴极上Cu2++2e-=Cu,当得到64g精铜时,转移电子是2mol,根据电子守恒,转移2mol电子,消耗金属钠的物质的量是2mol,质量是46g,
故答案为:Na,xS+2e-=Sx2-,46.
②金属铝可以和氧化铁在高温下反应生成金属铁和氧化铝,该反应为铝热反应,可以生产铁,即2Al+Fe2O3
| ||
| ||
③氯气具有氧化性,能将溴离子氧化为溴单质,2Br-+Cl2=2Cl-+Br2,溴水可以和碱性碳酸钠之间反应得到溴化钠、溴酸钠和二氧化碳气体,实质是:3Br2+3CO32-=5Br-+BrO3-+3CO2↑,故答案为:2Br-+Cl2=2Cl-+Br2,3Br2+3CO32-=5Br-+BrO3-+3CO2↑;
(2)①燃料电池中燃料甲烷失电子的电极是负极,电极反应为:CH4+10OH--8e-=CO32-+7H2O,故答案为:CH4+10OH--8e-=CO32-+7H2O;
②根据电池反应为2Na+xS=Na2Sx,失电子的是金属钠,所以Na是负极,Na-e-=Na+,在正极上是S得电子得到硫离子的过程,即xS+2e-=Sx2-,用该电池作电源进行粗铜精炼时,阴极上Cu2++2e-=Cu,当得到64g精铜时,转移电子是2mol,根据电子守恒,转移2mol电子,消耗金属钠的物质的量是2mol,质量是46g,
故答案为:Na,xS+2e-=Sx2-,46.
点评:本题考查学生元素以及化合物的性质、电化学中原电池的工作原理以及电子守恒的应用等知识,属于综合知识的考查,难度不大.

练习册系列答案
相关题目


 2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=
2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K= CO2
+2H2O,可以设计出以NaOH溶液为电解质溶液的燃料电池,该电池工作时负极的电极反应式为:______________。
CO2
+2H2O,可以设计出以NaOH溶液为电解质溶液的燃料电池,该电池工作时负极的电极反应式为:______________。