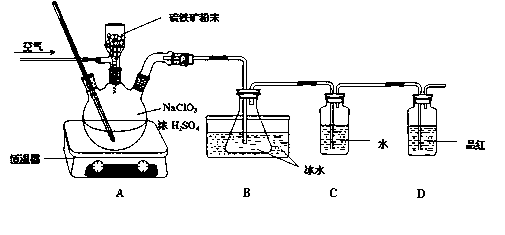
题目内容
 亚铁盐在空气中易被氧化,但形成复盐可稳定存在.硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,商品名为摩尔盐,易溶于水,不溶于乙醇. 通常可用如下步骤在实验室中少量制备:
亚铁盐在空气中易被氧化,但形成复盐可稳定存在.硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,商品名为摩尔盐,易溶于水,不溶于乙醇. 通常可用如下步骤在实验室中少量制备:步骤I:铁屑的净化
将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁粉.
步骤2:硫酸亚铁的制取
向处理过的铁屑中加入过量的3moL?L-1H2SO4溶液,在600c左右使其反应到不再 产生气体,趁热过滤,得FeSO4溶液.
步骤3:晶体的制备
向所得FeSO4溶液中加入少景3moL?L-1H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后得到硫酸亚铁铵晶体.
请回答下列问题:
(1)在步骤I的操作中,分离出液体的方法通常不用过滤,使用的操作是
①铁架台②燃烧匙③烧杯④广口瓶
⑤研钵 ⑥玻璃棒⑦酒精灯
(2)在步骤2中加热的同时应适当补充水,使溶液的体 积基本保持不变,这样做的原因是
(3)在步骤3中,先加少最稀硫酸的作用是
(4)本实验制取的硫酸亚铁铵晶体常含有Fe3+杂质.检验晶体中含有Fe3+方法是
(2)当溶剂减少时溶质硫酸亚铁晶体可能析出,加水使溶液的体积基本保持不变,可防止硫酸亚铁晶体析出;
(3)加入少量硫酸可以抑制亚铁离子和铵根离子水解,得到更多的产品;蒸发浓缩时加热到溶液表面有晶膜出现时停止加热:通过减压过滤(或抽滤)等得到较为干燥的晶体;抽滤后还要用少量酒精来洗去晶体表面杂质;
(4)检验Fe3+常用的试剂是KSCN溶液,Fe3+与KSCN溶液反应,溶液显血红色,说明含有Fe3+.
故答案为:倾析;③⑥;
(2)在步骤2中加热,溶剂随温度的升高减少,如果不适当补充水,硫酸亚铁晶体可能析出,所以加水使溶液的体积基本保持不变,可防止硫酸亚铁晶体析出,
故答案为:可防止硫酸亚铁晶体析出;
(3)NH4++H2O?NH3?H2O+H+;Fe2++2H2O?Fe(OH)2+2H+,NH4+、Fe2+水解呈酸性,加入少量硫酸抑制Fe2+、NH4+的水解,得到更多的产品;硫酸亚铁铵晶体中的结晶水受热容易失去,蒸干会使晶体分解,所以蒸发浓缩时加热到溶液表面有晶膜出现时停止加热,采取蒸发浓缩、冷却结晶方法,通过减压过滤(或抽滤)等得到较为干燥的晶体;乙醇易挥发,抽滤后还要用少量酒精来洗去晶体表面杂质,
故答案为:防止Fe2+、NH4+的水解;溶液表面有晶膜出现;防止倒吸;酒精;
(4)检验Fe3+常用的试剂是KSCN溶液,将晶体配成溶液,向溶液中滴入KSCN溶液,Fe3++3SCN-?Fe(SCN)3,溶液变为血红色,说明含有Fe3+,
故答案为:取少量晶体溶于水,滴加KSCN,溶液显血红色.

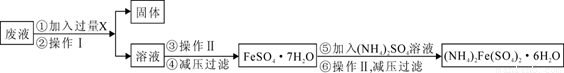
亚铁盐中,FeSO4•7H2O露置于空气中易被氧气氧化,而莫尔盐[(NH4)2SO4•FeSO4•6H2O]露置于空气中不易被氧气氧化,是一种重要的定量分析试剂。其制备原理是:FeSO4+(NH4)2SO4+6H2O =(NH4)2SO4•FeSO4•6H2O。
实验室用废铁屑制备莫尔盐的过程如下:

(1)步骤I除锈的操作是:将废铁屑放入烧杯, ,过滤,洗涤。
(2)步骤II铁屑的溶解在锥形瓶中进行,并水浴加热到60℃左右,需要的仪器是铁架台、石棉网、大烧杯、 。
(3)步骤III中加入的(NH4)2SO4与溶液中FeSO4的物质的量需满足的关系为:n[(NH4)2SO4]∶n[FeSO4]= 。
为了确定(NH4)2SO4的用量,下列方法简便可行的是 (填编号)。
A.称量废铁屑的质量,推算所需(NH4)2SO4的质量
B.称量无锈铁屑和步骤II之后剩余铁屑的质量,推算所需(NH4)2SO4的质量
C.测定FeSO4溶液的浓度和体积,推算所需(NH4)2SO4的质量
(4)所得晶体样品中可能混有的杂质是FeSO4·7H2O和(NH4)2SO4中的一种。某小组 设计了如下方案进行检验和测定,请在答题卡上完成表中内容。
|
序号 |
实验方案 |
实验现象和结论 |
|
步骤1 |
取少量样品 |
样品颜色可能有变化。 |
|
步骤2 |
步骤1后将样品转移到试管中,加入去氧蒸馏水,振荡溶解,调节至酸性,________ ___________ __ 。 |
若 ,说明样品中含有FeSO4·7H2O杂质。 |
|
步骤3 |
若步骤2证明样品不含FeSO4•7H2O杂质,再另取样品测定其中NH4+的质量分数w1与理论值w2比较。 |
若w1 w2,说明样品中含有(NH4)2SO4杂质。 |
(已知(NH4)2SO4•FeSO4•6H2O的式量为392,(NH4)2SO4的式量为132)