题目内容
【题目】现有A、B、C、D、E、F六种短周期元素,原子序数依次增大.已知A与D、C与E分别同主族,D、E、F同周期;A、B的最外层电子数之和与C的最外层电子数相等,A与C形成的化合物常温下均为液态,A分别与E、F形成的气体分子电子总数相等.
请回答下列问题:
(1)元素B在周期表中的位置是____________,元素D的原子结构示意图为__________.
(2)A2C比A2E沸点高的原因是__________________________________.
(3)在一定条件下,A、C的单质和A、C、D形成的离子化合物的水溶液可构成电池,该电池正极的电极反应式为_________________,负极的电极反应式为____________________,该电池在放电过程中,电解质溶液的pH将______(填“增大”、“减小”或“不变”).
(4)化合物B2A4和B2C4的液体曾被用作火箭推进剂,燃烧反应的生成物是一种气态单质和一种化合物,它们对环境无污染.1molB2A4与B2C4完全反应生成两种气体时放出热量516.8kJ,则该反应的热化学方程式为___________________________________________.
【答案】 第二周期第ⅤA族  H2O分子间存在氢键而H2S分子间不能形成氢键 O2+2H2O+4e- ═ 4OH- 2H2+4OH- --4e- ═ 4H2O 减小 2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H=-1033.6kJ.mol-1
H2O分子间存在氢键而H2S分子间不能形成氢键 O2+2H2O+4e- ═ 4OH- 2H2+4OH- --4e- ═ 4H2O 减小 2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H=-1033.6kJ.mol-1
【解析】A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与C形成的化合物常温下均为液态,化合物为水、过氧化氢,则A为H元素,C为O元素;A、D同主族,D原子序数大于氧元素,则D为Na元素;C与E同主族,则E为S元素;A、B的最外层电子数之和与C的最外层电子数相等,B的最外层电子数为6-1=5,原子序数小于氧元素,则B为N元素;D、E、F同周期,A能分别与E、F形成电子总数相等的气体分子,核外电子总数为18,则F为Cl元素;
(1)B为氮元素,在周期表中的位置是第二周期第ⅤA族,D为Na元素,原子结构示意图为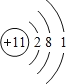 ;
;
(2)H2O分子间有氢键,H2S分子间不能形成氢键,所以沸点比H2S高;
(3)在一定条件下,氢气、氧气和NaOH的水溶液可构成电池,正极发生还原反应,氧气在正极放电生成氢氧根,正极电极反应式为O2+2H2O+4e-═4OH-,负极发生氧化反应,氢气在负极放电,碱性条件下生成水,负极电极反应为:2H2+4OH--4e-═4H2O,反应过程中生成H2O,使c(OH-)降低,pH减小;
(4)化合物N2H4和N2O4的液体曾被用作火箭推进剂,燃烧反应的生成物是一种气态单质和一种化合物,它们对环境无污染,生成氮气与液态水,1molN2H4与N2O4完全反应生成两种气体时放出热量516.8kJ,则2molN2H4反应放出的热量为516.8kJ×2=1033.6kJ,则该反应的热化学方程式为:2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H=-1033.6kJmol-1。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案

