题目内容
【题目】(题文)草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2===CaC2O4↓+2H2O。现用H2C2O4进行如下实验:
(一)探究草酸的不稳定性
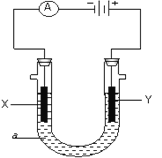
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:A.乙醇、B.________、C.NaOH溶液。

(1)B中盛装的试剂是________________(填化学式)。
(2)A中加入乙醇的目的是___________________。
(二)探究草酸的酸性
将0.01 mol草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是________________________ (用离子方程式表示)。
(三)用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
Ⅰ.实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸,反应原理:
![]() MnO
MnO![]() +
+![]() H2C2O4+
H2C2O4+![]() ____===
____===![]() Mn2++
Mn2++![]() CO2↑+
CO2↑+![]() H2O
H2O
(1)配平上述离子方程式。____________________
(2)滴定时KMnO4溶液应盛装于______________(填“酸式”或“碱式”)滴定管中。
Ⅱ.探究影响化学反应速率的因素
下表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
实验 组别 | c(H2C2O4) (mol·L-1) | V(H2C2O4) (mL) | c(KMnO4) (mol·L-1) | V(KMnO4) (mL) | c(H2SO4) (mol·L-1) | 褪色所 需时间 | 实验 目的 |
1 | 0.2 | 2 | 0.002 5 | 4 | 0.12 | 6′55″ | (a) |
2 | 0.2 | 2 | 0.005 | 4 | 0.12 | 5′17″ | |
3 | 0.2 | 2 | 0.01 | 4 | 0.12 | 3′20″ | |
4 | 0.2 | 2 | 0.02 | 4 | 0.12 | 9′05″ | |
5 | 0.2 | 2 | 0.03 | 4 | 0.12 | 11′33″ | |
6 | 0.2 | 2 | 0.04 | 4 | 0.12 | 14′20″ |
请回答:
(1)实验目的(a)是___________________________________________。
(2)若要探究催化剂对该反应速率的影响,应选择MnSO4而不选MnCl2作为催化剂,其原因是_____________________________________________________________。
【答案】Ca(OH)2溶液或Ba(OH)2溶液除去H2C2O4,避免其对CO2的检验造成干扰C2O42-+H2O![]() HC2O
HC2O![]() +OH-2 5 6 H+ 2 10 8酸式探究高锰酸钾溶液浓度对化学反应速率的影响Cl-可与酸性KMnO4溶液发生氧化还原反应
+OH-2 5 6 H+ 2 10 8酸式探究高锰酸钾溶液浓度对化学反应速率的影响Cl-可与酸性KMnO4溶液发生氧化还原反应
【解析】
考查对草酸性质的探究实验的设计与评价,化学方程式的配平,气体的检验。(1)草酸分解的混合气体中含有未分解的草酸,草酸与氢氧化钙反应生成醋酸钙沉淀,干扰二氧化碳的检验;草酸是二元酸,与氢氧化钠反应时二者恰好完全反应,若草酸是强酸,则反应后的溶液为中性,现在溶液呈碱性,说明草酸为弱酸,草酸根离子水解,使溶液呈碱性;高锰酸根离子中Mn元素的化合价从+7价降低到+2价,得到5个电子,草酸中C元素的化合价从+3价升高到+4价,共失去2个电子,根据得失电子守恒完成;高锰酸钾的氧化性强,易腐蚀碱式滴定管的胶管,所以用酸式滴定管盛放高锰酸钾;由表中数据可知,草酸的浓度、体积都不变,稀硫酸的浓度不变,草酸的浓度变化,体积不变;因为高锰酸钾可以氧化氯离子为氯气,影响对催化剂对反应速率影响的探究。
(一)(1)草酸混合气体中含有未分解的草酸,草酸与氢氧化钙反应生成醋酸钙沉淀,干扰二氧化碳的检验,所以A中的乙醇目的是除去草酸,则B中的试剂是Ca(OH)2或Ba(OH)2溶液,目的是检验二氧化碳的存在,C中氢氧化钠的作用是除去二氧化碳,以便检验CO的存在;答案:Ca(OH)2溶液或Ba(OH)2溶液。
(2)A中乙醇的目的是除去H2C2O4,避免对CO2的检验造成干扰;答案:除去H2C2O4,避免其对CO2的检验造成干扰。
(二)草酸是二元酸,与氢氧化钠反应时二者恰好完全反应,若草酸是强酸,则反应后的溶液为中性,现在溶液呈碱性,说明草酸为弱酸,草酸根离子水解,使溶液呈碱性,离子方程式为C2O42-+H2O![]() HC2O
HC2O![]() +OH-;答案:C2O42-+H2O
+OH-;答案:C2O42-+H2O![]() HC2O
HC2O![]() +OH-。
+OH-。
(三)I.(1)高锰酸根离子中Mn元素的化合价从+7价降低到+2价,得到5个电子,草酸中C元素的化合价从+3价升高到+4价,共失去2个电子,根据得失电子守恒,则高锰酸根离子的系数是2,草酸的系数是5,根据元素守恒配平Mn2+、CO2的系数,最后根据电荷守恒配平氢离子、水的系数。所以答案为2 5 6 H+ 2 10 8。
(2)高锰酸钾的氧化性强,所以不能用碱式滴定管,易腐蚀碱式滴定管的胶管,所以用酸式滴定管盛放高锰酸钾;答案:酸式。
II.(1)由表中数据可知,草酸的浓度、体积都不变,稀硫酸的浓度不变,高锰酸钾的浓度变化,体积不变,所以褪色所需时间就不同,所以a的目的是探究高锰酸钾溶液浓度对化学反应速率的影响。答案:探究高锰酸钾溶液浓度对化学反应速率的影响。
(2)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,是因为高锰酸钾具有强氧化性,可以氧化氯离子为氯气,影响催化剂对反应速率影响的探究。答案:Cl-可与酸性KMnO4溶液发生氧化还原反应。