题目内容
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
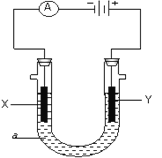
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则可观察到在X极附近观察到的现象是__________电极反应式是________________检验Y电极反应产物的方法是____________________电解一段时间之后溶液的PH将会________(升高、降低或不变),总方程式为_________________________。
(2)若X、Y都是铜电极,a是稀CuSO4溶液,开始实验,X极的电极反应式是__________________________。电解前后CuSO4溶液的浓度___________________(变大、变小或不变)若X电极质量增重64克,则在电路中有_________________mol的电子发生转移。
(3)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则①X电极的材料是_____,电极反应式是_____________。②Y电极的材料是______,电极反应式是____________________。(说明:杂质发生的电极反应不必写出)
【答案】 放出气体,溶液变红 2H+ + 2e- = H2↑ 把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色 升高 2NaCl+2H2O==2NaOH+H2+Cl2 Cu2++2e-==Cu 不变 2mol 纯铜(或精铜) Cu2+ + 2e - =Cu 粗铜 Cu-2e-=Cu2+
【解析】(1)和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,可观察到在X极附近观察到的现象是放出气体,溶液变红,电极反应式是2H+ + 2e- = H2↑;和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应产生氯气,检验Y电极反应产物的方法是把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色;电极总反应为2NaCl+2H2O==2NaOH+H2+Cl2,电解时氢离子消耗,氢氧根离子浓度增大,电解一段时间之后溶液的PH将会升高;(2)若X、Y都是铜电极,a是稀CuSO4溶液,开始实验,X极为阴极铜离子得电子产生铜单质,电极反应式是Cu2++2e-==Cu;阳极铜失电子产生铜离子进入溶液中,故电解前后CuSO4溶液的浓度不变;若X电极质量增重64克,则析出1mol铜,则在电路中有2mol电子发生转移;(3)①电解方法精炼粗铜,电解池的阴极材料是纯铜(或精铜),电极反应为:Cu2++2e-=Cu;②电解方法精炼粗铜,电解池的阳极材料是粗铜,电极反应为:Cu-2e-=Cu2+。

 阅读快车系列答案
阅读快车系列答案【题目】(题文)草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2===CaC2O4↓+2H2O。现用H2C2O4进行如下实验:
(一)探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:A.乙醇、B.________、C.NaOH溶液。

(1)B中盛装的试剂是________________(填化学式)。
(2)A中加入乙醇的目的是___________________。
(二)探究草酸的酸性
将0.01 mol草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是________________________ (用离子方程式表示)。
(三)用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
Ⅰ.实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸,反应原理:
![]() MnO
MnO![]() +
+![]() H2C2O4+
H2C2O4+![]() ____===
____===![]() Mn2++
Mn2++![]() CO2↑+
CO2↑+![]() H2O
H2O
(1)配平上述离子方程式。____________________
(2)滴定时KMnO4溶液应盛装于______________(填“酸式”或“碱式”)滴定管中。
Ⅱ.探究影响化学反应速率的因素
下表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
实验 组别 | c(H2C2O4) (mol·L-1) | V(H2C2O4) (mL) | c(KMnO4) (mol·L-1) | V(KMnO4) (mL) | c(H2SO4) (mol·L-1) | 褪色所 需时间 | 实验 目的 |
1 | 0.2 | 2 | 0.002 5 | 4 | 0.12 | 6′55″ | (a) |
2 | 0.2 | 2 | 0.005 | 4 | 0.12 | 5′17″ | |
3 | 0.2 | 2 | 0.01 | 4 | 0.12 | 3′20″ | |
4 | 0.2 | 2 | 0.02 | 4 | 0.12 | 9′05″ | |
5 | 0.2 | 2 | 0.03 | 4 | 0.12 | 11′33″ | |
6 | 0.2 | 2 | 0.04 | 4 | 0.12 | 14′20″ |
请回答:
(1)实验目的(a)是___________________________________________。
(2)若要探究催化剂对该反应速率的影响,应选择MnSO4而不选MnCl2作为催化剂,其原因是_____________________________________________________________。
【题目】如图所示,室温下两个容积相等的烧瓶A、B中分别集满了两种气体(同温同压,列于下表中),现打开活塞K,使两个烧瓶内的气体充分接触,则容器内的压强按由小到大的顺序排列正确的是

编号 | ① | ② | ③ |
A中气体 | SO2 | NH3 | NO |
B中气体 | O2 | HCl | O2 |
A. ①②③ B. ②③① C. ③②① D. ①③②

