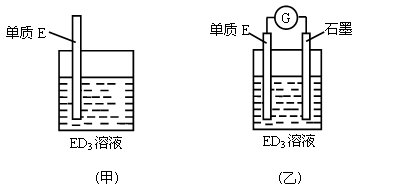
题目内容
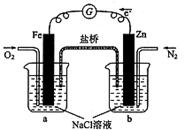
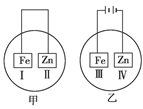
一个原电池的总反应的离子方程式是Zn+Cu2+ ="==" Zn2+ + Cu,该反应的原电池的正确组成是( )
| | A | B | C | D |
| 正极 | Zn | Cu | Zn | Fe |
| 负极 | Cu | Zn | Ag | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | CuCl2 |
D
试题分析:根据反应的方程式可知,锌失去电子,铜离子得到电子,所以如果构成原电池,则负极材料是锌,正极材料的金属性要弱于锌的,而电解质是含有铜离子的溶液,所以正确的答案选D。
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以进行有关的判断和计算。

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目

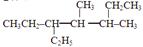 ,它的分子式是 ,名称是 。
,它的分子式是 ,名称是 。
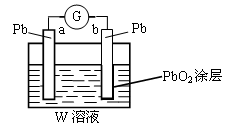
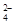 +2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。若电池工作一段时间后,a极消耗0.05 mol Pb,则W的浓度由质量分数39 % (密度1.3 g / cm3)变为______mol /L。
+2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。若电池工作一段时间后,a极消耗0.05 mol Pb,则W的浓度由质量分数39 % (密度1.3 g / cm3)变为______mol /L。