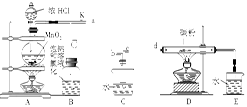题目内容
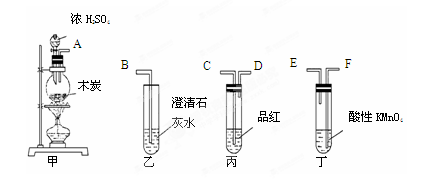
(9分)一定量的浓硫酸与足量Zn充分反应时有SO2和H2生成。某校化学研究性学习小组从定性方面对此作了研究。
按图组装好实验装置,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊,后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加。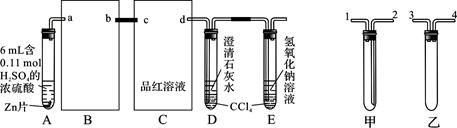
试回答下列问题:
(1)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接______、______接b,c接______、______接d;D、E两支试管中CCl4的作用是________________________。
(2)能证明浓硫酸具有强氧化性的实验现象为_______________________________;实验过程中,浓硫酸表现强氧化性的反应方程式是:
____________________________________________________________________
(3)反应较长时间后气泡量又会明显增加的原因是________________________________
____________________________________。
(1)3(或4)、4(或3)(1分); 2、1(1分);防止倒吸(1分);
(2)C中品红溶液褪色(2分);Zn+2H2SO4=ZnSO4+SO2↑+2H2O(2分);
(3)浓H2SO4变成稀H2SO4,与Zn反应放出H2(2分);
解析试题分析:(1)B的作用是防止倒吸,可将乙填入B中;C装置的作用是检验二氧化硫的漂白性,可用洗气装置,可将甲填入C中,且为长进短出,DE中的四氯化碳可以防止气体吸收时倒吸;故答案为:3(或4);4(或3); 2; 1;防止倒吸。
(2)有二氧化硫生成能证明浓硫酸具有强氧化性,二氧化硫能使品红褪色,所以能证明浓硫酸具有强氧化性的实验现象为:C中品红溶液褪色;H2SO4中S元素化合价由+6价降低到+4价,所以浓硫酸表现强氧化性的反应方程式是:Zn+2H2SO4=ZnSO4+SO2↑+2H2O。
(3)随反应进行,H2SO4的浓度逐渐减小,浓H2SO4变成稀H2SO4,与Zn反应放出H2。
考点:本题考查实验方案的设计与分析、化学方程式的书写。

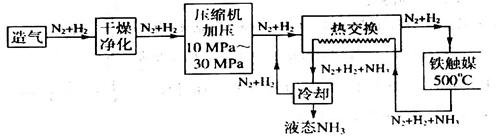
氨气是化学工业上应用非常广泛的物质。下面仅是它在两方面的重要用途。
“侯氏制碱法”的发明为振兴中国化工工业做出了重要贡献。制碱法的第一步反应是向饱和氨化盐水中通入二氧化碳,该反应可表示为:NaCl + CO2 + NH3 + H2O → NaHCO3↓+ NH4Cl
现在45℃时,取117g食盐配制成饱和溶液,向其中通入适量氨气后,再向其中通入二氧化碳,使反应进行完全。试计算并回答下列问题(计算结果取三位有效数字)(有关物质的溶解度数据如表,单位:g/100g水)。
| | NaCl | NaHCO3 | NH4Cl |
| 10℃ | 35.8 | 8.15 | 33.0 |
| 45℃ | 37.0 | 14.0 | 50.0 |
(1)117g食盐理论上可以制取纯碱 g;
(2)45℃反应完毕后,有晶体析出;溶液中剩余水 g,析出晶体的质量 g。
(3)过滤除去析出的晶体后再降温至10℃,又有晶体析出,计算所析出晶体的质量共 克
工业制硝酸也是氨气重要用途之一,反应如下:
4NH3+5O2→4NO+6H2O 2NO+O2→2NO2 3NO2+H2O→2HNO3+NO
将a mol的NH3与b mol的O2混合后,充入一密闭容器,在Pt存在下升温至700℃,充分反应后,冷却至室温。
 (4)请讨论b∕a的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中:
(4)请讨论b∕a的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中:| b∕a的取值范围 | 溶质 | 溶质物质的量 |
| | | |
 | —— | —— |
| | | |
| | | |
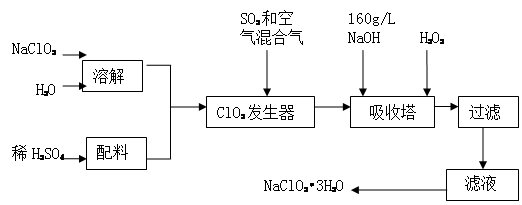
S2C12是一种金黄色易挥发的液体,常用作橡胶硫化剂。某化学兴趣小组拟设计实验制备少量的S2C12,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化合价升高,另一部分化合价降低)。加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2C12,反应的化学方程式为:2S+Cl2 S2Cl2。
S2Cl2。
反应涉及的几种物质的熔沸点如下:
| 物质 | S | S2Cl2 |
| 沸点/℃ | 445 | 138 |
| 熔点/℃ | 113 | -76 |
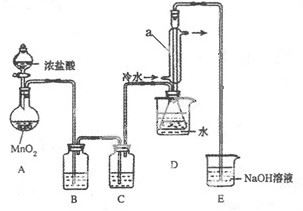
回答下列问题:
(1)连接好实验装置后的第一步实验操作是______。
(2)实验中需要加热的仪器是 (填写字母)
(3)装置B、C中的试剂分别是 。
(4)装置D中仪器a的作用是 。
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是____________。
(6)若实验过程中缺少C装置,发现产品浑浊不清,请用化学方程式表示其原因____________。
(7)实验完毕,小组中的一位同学把剩余浓盐酸倒入E烧杯中,发现有黄绿色剌激性气体产生。用离子方程式表示产生该现象的原因____________。
 粗产品加入到过量的NaOH溶液中充分反应,收集到0.1mol氢气,过滤得SiC固体11.4g,滤液稀释到1L,生成氢气的离子方程式为,硅酸钠的物质的量浓度为
粗产品加入到过量的NaOH溶液中充分反应,收集到0.1mol氢气,过滤得SiC固体11.4g,滤液稀释到1L,生成氢气的离子方程式为,硅酸钠的物质的量浓度为