��Ŀ����
����Ŀ�������������ƣ�Na2S2O4���ֳƱ��շۣ���ӡˢ��ҵ����Ҫ�Ļ�ԭ����ij����С���������ʵ�飮���IJ���
�������������ƣ�Na2S2O4����һ�ְ�ɫ��ĩ��������ˮ���������Ҵ���
��2Na2S2O4+4HCl�T4NaCl+S��+3SO2��+2H2O
Na2S2O3+2HCl�T2NaCl+S��+SO2��+H2O
��1���Ʊ�����75��ʱ�������ƺʹ�������Ҵ�ˮ��Һ�У�ͨ��SO2���з�Ӧ������䷴Ӧ����ʽ��
HCOONa+Na2CO3+=Na2S2O4+CO2+
��ȴ��40�桫45�棬���ˣ���ϴ�ӣ������Ƶ�Na2S2O4 ��
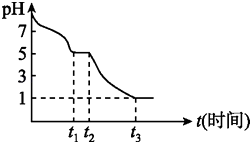
��2��Na2S2O4�����ʢ�Na2S2O4 ��Һ�ڿ������ױ�����������С��ⶨ0.050 molL��1 Na2S2O4 ��Һ�ڿ�����pH�仯��ͼ��0��t1 ����Ҫ����HSO3�� �� ����pH�仯ͼ��HSO3���ĵ���ƽ��ˮ��ƽ�⣨�����������������С���Ʋ�Na2S2O4 ��Һ�ڿ������ױ�������0��t1 �������ӷ�Ӧ����ʽΪ �� t3 ʱ��Һ����Ҫ�����ӷ����� ��
�ڸ�����������Na2S2O4 ������ȫ�ֽ�õ��������Na2SO3��Na2S2O3 ������Ϊ���ѧʽ�����������ʵ����֤������Na2S2O3 ���ڣ�����±������ݣ�����ѡ����Լ���ϡ���ᡢϡ���ᡢBaCl2 ��Һ��KMnO4 ��Һ��
ʵ�鲽�裨��Ҫ��д������������̣� | Ԥ�ڵ�ʵ������ͽ��� |
���𰸡�
��1��2��1��4SO2��2��3��H2O���Ҵ�
��2������2S2O42��+O2+2H2O=4HSO3����SO42����SO2��ȡ������ȫ�ֽ�Ĺ���������Թ��У�����ϡ������е���ɫ����������Na2S2O3����
���������⣺��1����Ӧ��SԪ�صĻ��ϼ۴�+4�۽��͵�+3�ۣ��õ�1�����ӣ���������̼Ԫ�صĻ��ϼ۴�+2�����ߵ�+4�ۣ�����ݵ��ӵ�ʧ�غ��ԭ���غ��֪��Ӧ�Ļ�ѧ����ʽΪ2HCOONa+Na2CO3+4SO2=2Na2S2O4+3CO2+H2O����������������һ�ְ�ɫ��ĩ��������ˮ���������Ҵ�����˿������Ҵ�ϴ�Ӳ�Ʒ�����Դ��ǣ�2HCOONa+Na2CO3+4SO2=2Na2S2O4+3CO2+H2O���Ҵ�����1��Na2S2O4��Һ�ڿ������ױ������������������ƣ���0��t1�η������ӷ�Ӧ����ʽΪ 2S2O42��+O2+2H2O=4HSO3�� �� 0��t1����Ҫ������HSO3�� �� ��Һ�����ԣ�HSO3���ĵ���̶ȴ���ˮ��̶ȣ�t3ʱ��Һ��pH=1��˵����Һ�����Խ�ǿ��������������Ʊ�����Ϊ�������ƣ�����Һ����Ҫ�����ӷ�����SO42�� �� ���Դ��ǣ�����2S2O42��+O2+2H2O=4HSO3����SO42������2��������������Na2S2O4������ȫ�ֽ⣬�õ��������Na2SO3��Na2S2O3�����壬�����������������������Na2S2O3��S��+2�ۣ������������ԭ��Ӧ�е��ӵ�ʧ�غ��֪����Ӧ����SO2 �� ���ݷ�ӦNa2S2O3+2HCl=2NaCl+S��+SO2��+H2O��֪Ҫ������������ƣ���ֻ��Ҫȡ������ȫ�ֽ�Ĺ���������Թ��У�����ϡ���ᣬ����е���ɫ����������Na2S2O3���ڣ����Դ��ǣ�SO2��
ʵ�鲽�裨��Ҫ��д������������̣� | Ԥ�ڵ�ʵ������ͽ��� |
ȡ������ȫ�ֽ�Ĺ���������Թ��У�����ϡ���� | ���е���ɫ����������Na2S2O3���� |

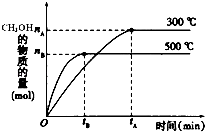
����Ŀ���ڱ�״���½��мס��ҡ�������ʵ�飬����ʵ�����ȡ30mLͬŨ�ȵ�������Һ������ͬһ��þ���Ͻ��ĩ���������壬�й����������
ʵ����� | �� | �� | �� |
�Ͻ�����/mg | 255 | 385 | 459 |
�����������/mL | 280 | 336 | 336 |
��1������ʵ����,����______(�����������������������������)��
��2����������ʵ���Ũ��Ϊ_______��
��3��Ҫ����Ͻ���þ���������ʵ���֮�ȣ����п���Ϊ�������ݵ�������_______(����顱�������顱���顱)����õ�þ���������ʵ���֮����_____��