题目内容
【题目】25℃时,用0.02mol/L的NaOH溶液,分别滴定浓度为0.0lmol/L的三种稀酸溶液,滴定的曲线如右图所示,下列判断正确的是

A. 三种酸均为弱酸,且同浓度的稀酸中导电性:HA<HB<HD
B. 滴定至P点时,溶液中:c(HB)>c(B-)
C. 溶液呈中性时,三种溶液中:c(A-)>c(B-)>c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-2c(H+)
【答案】C
【解析】
由图象中未加NaOH时三种酸溶液的pH由小到大可知,三种酸的酸性强弱顺序为:HA>HB>HD。
A.酸性越强,酸的电离程度越大,HA的pH最小,酸性最强,电离程度最大,则同浓度的稀酸中离子浓度最大,故等浓度的稀酸溶液的导电性:HA>HB>HD,A错误;
B.滴定至P点时,中和率为50%,HB溶液中的溶质为等物质的量的HB、NaB,由于溶液的pH<7,溶液显酸性,说明HB的电离程度大于B-的水解程度,所以溶液中:c(B-)>c(HB), B错误;
C.pH=7时,溶液中c(H+)=c(OH-),根据电荷守恒,对于HA溶液,c(Na+)=c(A-),对于HB溶液,c(Na+)=c(B-),对于HD溶液,c(Na+)=c(D-),,由于HA、HB、HD的酸性减弱,则使溶液呈中性时,三种溶液中c(Na+)逐渐减小,则c(A-)>c(B-)>c(D-),C正确;
D.当中和百分数达100%时,三种溶液分别恰好存在等量的NaA,NaB,NaD,则起始时c(NaA):c(NaB):c(NaD)=1:1:1,由质子守恒可知c(HA)+c(HB)+c(HD)+c(H+)=c(OH-),则有c(HA)+c(HB)+c(HD)=c(OH-)-c(H+),D错误;
故合理选项是C。

【题目】焦炭是重要的工业原材料。
(1)已知在一定温度下,C(s)+CO2(g) ![]() 2CO(g) 平衡常数K1;C(s)+H2O(g)
2CO(g) 平衡常数K1;C(s)+H2O(g) ![]() CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g)
CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g) ![]() H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
(2)用焦炭还原NO的反应为:2NO(g)+ C(s)![]() N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(NO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=_____________ ;
②该反应的平衡常数表达式为__________________;400℃,该反应的平衡常数为_______;
③乙容器的反应温度T____400 ℃(填“>”“<”或“=”)
④丙容器达到平衡时,NO的转化率为___________;平衡时CO2的浓度为________。
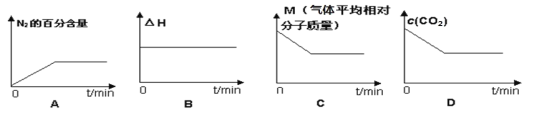
⑤在恒容密闭容器中加入焦炭并充入NO气体,下列图像正确且能说明反应达到平衡状态的是___。
【题目】下表所列各组物质中,物质之间按箭头方向不能通过一步反应实现如图所示转化的是
![]()
物质 选项 | 甲 | 乙 | 丙 |
A | CuO | CO2 | H2O |
B | C | CO | CO2 |
C | CaCO3 | CaO | Ca(OH)2 |
D | H2SO4 | H2O | H2 |
A.AB.BC.CD.D






