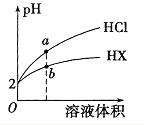
题目内容
【题目】钒、钛、铝组成的金属合金![]() 常用于飞机发动机、宇航船舱骨架、导弹、军舰的水翼等。钒精矿可表示为
常用于飞机发动机、宇航船舱骨架、导弹、军舰的水翼等。钒精矿可表示为![]() ,还含有其他难溶硫酸盐杂质。“萃取”钒工艺流程路线图如下:
,还含有其他难溶硫酸盐杂质。“萃取”钒工艺流程路线图如下:
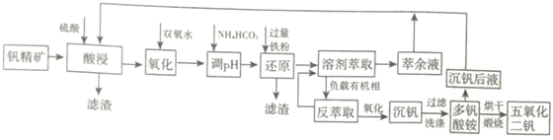
已知:①![]() 中
中![]() 为
为![]() 价。
价。
②“氧化”后的溶液中钒以![]() 存在,反萃取后的溶液中钒以
存在,反萃取后的溶液中钒以![]() 存在。
存在。
③![]() 为萃取剂。
为萃取剂。
回答下列问题:
(1)将钒精矿![]() 写成氧化物的形式____________________________。
写成氧化物的形式____________________________。
(2)写出“氧化”过程中反应的离子方程式____________________________。
(3)加入![]() 调节溶液
调节溶液![]() 的目的是____________________________。
的目的是____________________________。
(4)“还原”过程中主要反应的离子反应方程式为____________________________。
(5)为了提高![]() 的产率,反萃取剂应该呈_________(填“酸性”“碱性”或“中性”)。
的产率,反萃取剂应该呈_________(填“酸性”“碱性”或“中性”)。
(6)若用氧化剂![]() “氧化沉钒”时,生成
“氧化沉钒”时,生成![]() ,至少需要
,至少需要![]() _________
_________![]() 。
。
(7)写出煅烧多钒酸铵![]() 的化学反应方程式__________________。
的化学反应方程式__________________。
【答案】![]() (或
(或![]() )
) ![]() 使
使![]() 转变成沉淀而除去
转变成沉淀而除去 ![]() 酸性 745
酸性 745 ![]()
【解析】
(1)根据质量守恒和硅酸盐以氧化物形式表示“活泼金属氧化物·较活泼金属氧化物![]() ”,;
”,;
(2)根据流程图及已知信息②,![]() 将
将![]() 氧化为
氧化为![]() ;
;
(3)根据流程图分析可知,溶液中含有剩余的氢离子,及溶解产生的杂质铝离子、铁离子;
(4)根据流程图及已知信息②,加入铁粉将![]() 还原为
还原为![]() ;
;
(5)酸性条件下,使![]() 平衡逆向移动;
平衡逆向移动;
(6) 氧化沉钒时![]() 被氧化为
被氧化为![]() ,生成1mol
,生成1mol![]() 转移1mol电子,故生成20mol
转移1mol电子,故生成20mol![]() 时,转移电子数为
时,转移电子数为![]() ,
,![]() 转化为
转化为![]() 得到电子
得到电子![]() ;
;
(7)根据流程图,多钒酸铵煅烧得到五氧化二钒,根据元素守恒写出化学反应方程式。
(1) ![]() 中Fe为+3价,根据化合物中元素的正负化合价代数和为0,其中V的化合价为+3价,根据质量守恒和硅酸盐以氧化物形式表示“活泼金属氧化物·较活泼金属氧化物
中Fe为+3价,根据化合物中元素的正负化合价代数和为0,其中V的化合价为+3价,根据质量守恒和硅酸盐以氧化物形式表示“活泼金属氧化物·较活泼金属氧化物![]() ”,
”,![]() 写成氧化物形式为
写成氧化物形式为![]() 或
或![]() ,故答案为:
,故答案为:![]() (或
(或![]() );
);
(2)根据流程图及已知信息②,![]() 将
将![]() 氧化为
氧化为![]() ,其离子反应方程式为
,其离子反应方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)根据流程图分析可知,溶液中含有剩余的氢离子,及溶解产生的杂质铝离子、铁离子,故加入![]() 发生
发生![]() 、
、![]() 、
、![]() ,将杂质离子转化为沉淀除去,故答案为:使
,将杂质离子转化为沉淀除去,故答案为:使![]() 转变成沉淀而除去;
转变成沉淀而除去;
(4)根据流程图及已知信息②,加入铁粉将![]() 还原为
还原为![]() ,结合得失电子守恒和质量守恒写出离子方程式:
,结合得失电子守恒和质量守恒写出离子方程式:![]() ,故答案为:
,故答案为:![]() ;
;
(5)酸性条件下,使![]() 平衡逆向移动,
平衡逆向移动,![]() 增多产率增大,故答案为:酸性;
增多产率增大,故答案为:酸性;
(6) 氧化沉钒时![]() 被氧化为
被氧化为![]() ,生成1mol
,生成1mol![]() 转移1mol电子,故生成20mol
转移1mol电子,故生成20mol![]() 时,转移电子数为
时,转移电子数为![]() ,
,![]() 转化为
转化为![]() 得到电子
得到电子![]() ,故至少需要
,故至少需要![]()
![]() ,质量为
,质量为![]() ,故答案为:745;
,故答案为:745;
(7)根据流程图,多钒酸铵煅烧得到五氧化二钒,根据元素守恒写出化学反应方程式:![]() ,故答案为:
,故答案为:![]() 。
。