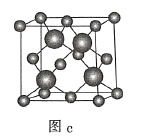
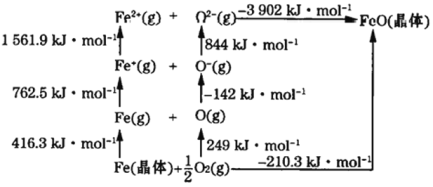题目内容
【题目】![]() 某有机物
某有机物![]() 和
和![]() 氧气在一密闭容器中充分燃烧,所得产物通过浓硫酸时使其增重
氧气在一密闭容器中充分燃烧,所得产物通过浓硫酸时使其增重![]() ,再通过足量灼热的氧化铜粉末,固体质量减少
,再通过足量灼热的氧化铜粉末,固体质量减少![]() ,最后再通过足量过氧化钠粉末,固体质量增加了
,最后再通过足量过氧化钠粉末,固体质量增加了![]() 。请回答:
。请回答:
(1)该化合物![]() 的分子式为_______。
的分子式为_______。
(2)简要写出推理过程_______。
【答案】C3H6O3 根据浓硫酸增重得n(H2O)=0.3mol
根据氧化铜固体减少的质量得n(CO)=0.1mol;
根据Na2O2可得混合气体中n(C)=0.3mol,因此n(CO2)=0.2mol,氧元素守恒得,有机物中n(O)=0.3mol
因此n(有机物):n(C):n(H):n(O)=1:3:6:3,分子式为C3H6O3。
【解析】
浓硫酸吸收燃烧产生的水,通过足量灼热的氧化铜粉末,燃烧产生的CO与氧化铜反应生成铜和二氧化碳,最后通入足量过氧化钠粉末,吸收产生的二氧化碳。
(1)浓硫酸增重5.4g,则燃烧产生水的质量为5.4g,物质的量为![]() ;通入氧化铜粉末,发生反应CO+CuO
;通入氧化铜粉末,发生反应CO+CuO![]() Cu+CO2,氧化铜减少1.6g,则燃烧产生CO的物质的量为
Cu+CO2,氧化铜减少1.6g,则燃烧产生CO的物质的量为![]() ,将产生二氧化碳通入过氧化钠粉末,发生反应2Na2O2+2CO2=2Na2CO3+O2,固体增重8.4g,则n(C)=
,将产生二氧化碳通入过氧化钠粉末,发生反应2Na2O2+2CO2=2Na2CO3+O2,固体增重8.4g,则n(C)= ![]() ,则燃烧产生二氧化碳的物质的量n(CO2)=0.2mol,氧元素守恒得,有机物中n(O)=0.3mol,因此n(有机物):n(C):n(H):n(O)=1:3:6:3,分子式为C3H6O3。
,则燃烧产生二氧化碳的物质的量n(CO2)=0.2mol,氧元素守恒得,有机物中n(O)=0.3mol,因此n(有机物):n(C):n(H):n(O)=1:3:6:3,分子式为C3H6O3。
(2)根据浓硫酸增重得n(H2O)=0.3mol
根据氧化铜固体减少的质量得n(CO)=0.1mol;
根据Na2O2可得混合气体中n(C)=0.3mol,因此n(CO2)=0.2mol,氧元素守恒得,有机物中n(O)=0.3mol;
因此n(有机物):n(C):n(H):n(O)=1:3:6:3,分子式为C3H6O3。

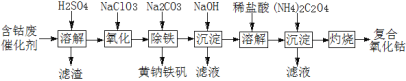
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】现向下列装置中缓慢通入气体X,分别进行关闭和打开活塞K的操作,则品红溶液和澄清石灰水中现象相同的一组是
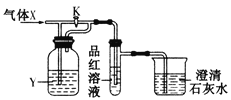
选项 | A | B | C | D |
X | NO2 | SO2 | Cl2 | CO2 |
Y(过量) | 浓H2SO4 | NaHCO3饱和溶液 | Na2SO3溶液 | NaHSO3饱和溶液 |
A.AB.BC.CD.D