��Ŀ����
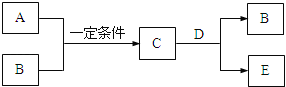
����Ŀ��A��B��C��D��E����ѧ��ѧ�еij������ʣ�A��B�Ƕ�����Ԫ����ɵĵ��ʣ���ת����ϵ��ͼ��
��ش�
��1����C����ɫ��ӦΪ��ɫ�������£�DΪ��ɫ���壬�ܲ�����ɫֲ��Ĺ�����ã�
�����A��Ԫ�������ڱ��е�λ���� ��
������������ȷ���� ������ĸ����
a��A����ˮ���ҷ�Ӧ
b��C��ˮ��Ӧ������B
c��E���ᷴӦ������D
��2����C����ʹʪ��ĺ�ɫʯ����ֽ���������壬D�ǻ���ɫ���壮
��C��D��Ӧ�Ļ�ѧ����ʽ�� ��
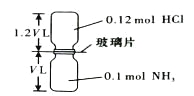
��������Ӧ��ת��1.2mol����ʱ������B�����Ϊ ����״������
���𰸡���1����������IA�壻abc��2��8NH3+3Cl2=N2+6NH4Cl��2NH3+3Cl2=N2+6HCl��4.48L
���������⣺��1����C����ɫ��ӦΪ��ɫ������NaԪ�أ������£�DΪ��ɫ���壬�ܲ�����ɫֲ��Ĺ�����ã���DΪCO2�����߷�Ӧ���ɵ���B����CΪNa2O2��BΪO2��EΪNa2CO3������AΪNa��
�����A��Ԫ��ΪNa�������ڱ��е�λ���ǣ���������IA�壬�ʴ�Ϊ����������IA�壻
��a��������ˮ���ҷ�Ӧ����������������������a��ȷ��
b������������ˮ��Ӧ������������������������b��ȷ��
c��̼�������ᷴӦ�����ɶ�����̼����c��ȷ��
��ѡ��abc��
��2����C����ʹʪ��ĺ�ɫʯ����ֽ���������壬��CΪNH3��D�ǻ���ɫ���壬��CΪCl2�������백����Ӧ���ɵ�����E����BΪN2��AΪH2��EΪHCl��NH4Cl��
��C��D��Ӧ�Ļ�ѧ����ʽ�ǣ�8NH3+3Cl2=N2+6NH4Cl��2NH3+3Cl2=N2+6HCl��
�ʴ�Ϊ��8NH3+3Cl2=N2+6NH4Cl��2NH3+3Cl2=N2+6HCl��
��������Ӧ��ת��1.2mol����ʱ�����ݵ���ת���غ㣬���ɵ������ʵ���Ϊ![]() =0.2mol������������Ϊ0.2mol��22.4L/mol=4.48L��
=0.2mol������������Ϊ0.2mol��22.4L/mol=4.48L��
�ʴ�Ϊ��4.48L��

 �Ͻ�ƽ��У����ϵ�д�
�Ͻ�ƽ��У����ϵ�д�