题目内容
【题目】I.化学电池在通讯、交通及日常生活中有着广泛的应用。
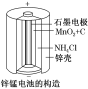
(1)锌锰干电池是应用最普遍的电池之一(如图所示),锌锰干电池的负极材料是__,负极发生的电极反应式为_____。若反应消耗16.25 g负极材料,则电池中转移电子的物质的量为____mol。
(2)目前常用的镍(Ni)镉(Cd)电池的电池总反应式可以表示为2Ni(OH)2+Cd(OH)2![]() Cd+2NiO(OH)+2H2O,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是________。
Cd+2NiO(OH)+2H2O,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是________。
A.NiO(OH)作负极 B.放电时化学能转变为电能
C.Cd作负极 D.此电池是一次电池
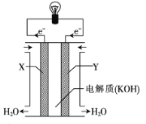
(3)如图为氢氧燃料电池的构造示意图,根据电子运动方向可知,则X极为电池的___(填“正”或“负”)极,X极的电极反应式为____。
II.工业合成氨的反应N2+3H2![]() 2NH3的能量变化如下图所示,请回答有关问题:
2NH3的能量变化如下图所示,请回答有关问题:
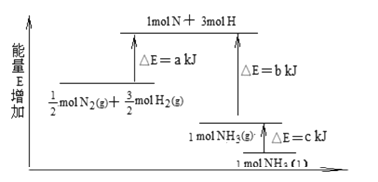
已知:拆开 lmol H—H 键、lmol N-H 键、lmol N≡N 键分别需要的能量是436kJ、391kJ、946kJ。
(1)则上图中的 a=___kJ;1 mol N2(g) 完全反应生成NH3(g)需要___(填“吸收”、“放出”)____kJ热量。
(2)推测反应 2NH3(l)![]() N2 (g)+3H2(g) 比反应2NH3(g)
N2 (g)+3H2(g) 比反应2NH3(g)![]() N2 (g)+3H2(g)______(填“吸收”、“放出”)的热量____(填“多”、“少”)。
N2 (g)+3H2(g)______(填“吸收”、“放出”)的热量____(填“多”、“少”)。
【答案】锌 Zn-2e-=Zn2+ 0.5 BC 负 H2-2e-+2OH-=2H2O 1127 放出 92 吸收 多
【解析】
I.(1)负极发生氧化反应,锌失电子;根据1mol锌失去2mol电子进行计算;
(2)该电池放电时为原电池,充电时为电解池,根据反应条件判断是可充电电池;
(3)根据负极反应为2H2-4e-+4OH-=2H2O,则通入氢气的一极为负极,发生氧化反应,并可判断溶液呈碱性,碱性溶液中负极发生氧化反应,据此分析;
II.(1)上图中的a等于断裂0.5mol氮气和1.5mol氢气所吸收的热量;1mol N2(g) 完全反应生成NH3(g)产生的能量变化为反应物的键能之和-生成物的键能之和;
(2)根据液体氨气转化为气态还要吸热判断.
I.(1)负极发生氧化反应,锌失电子,电极反应式为:Zn-2e-=Zn2+,16.25g锌是0.25mol,而1mol的锌失去2mol的电子,所以转移电子的物质的量为0.5mol;
(2)A.由反应2Ni(OH)2+Cd(OH)2![]() Cd+2NiO(OH)+2H2O,可知放电时NiO(OH)发生还原反应,作正极,故A错误;B.放电时是原电池,是将化学能转变为电能,故B正确;C.放电时,Cd发生氧化反应,作负极,故C正确;D.此电池是可充电电池,应是二次电池,故D错误;故答案为BC;
Cd+2NiO(OH)+2H2O,可知放电时NiO(OH)发生还原反应,作正极,故A错误;B.放电时是原电池,是将化学能转变为电能,故B正确;C.放电时,Cd发生氧化反应,作负极,故C正确;D.此电池是可充电电池,应是二次电池,故D错误;故答案为BC;
(3)X极的电极反应式为2H2-4e-+4OH-=2H2O,则通入氢气的X极为负极,发生氧化反应,电解质溶液呈碱性,则X极的电极反应为H2+2e-+2OH-=2H2O;
II.(2)上图中的a等于断裂0.5mol氮气和1.5mol氢气所吸收的热量,即946×0.5+436×1.5=1127kJ;1mol N2(g) 完全反应则消耗3mol氢气生成2molNH3(g)产生的能量变化为946+436×3-391×6= -92kJ,则需要放出92kJ的热量;
(3)因为合成 NH3放出热量,所以氨气分解吸收热量,又液体氨气转化为气态还要吸热,所以液态氨分解吸收的热量比气态氨吸收的热量多。