题目内容
1.0.5mol Na2SO4中所含的Na+离子数为( )| A. | 3.01×1023 | B. | 0.5 | C. | 6.02×1023 | D. | 1 |
分析 根据N=nNA结合物质的构成计算.
解答 解:0.5mol Na2SO4中所含的Na+离子的物质的量为1mol,个数为6.02×1023,故选C.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的有关计算公式.

练习册系列答案
相关题目
11.下列关于过滤操作的说法中,错误的是( )
| A. | 玻璃棒下端要靠在三层滤纸处 | |
| B. | 滤纸边缘低于漏斗边缘,多余部分要剪去,并用水润湿贴紧,不留气泡 | |
| C. | 过滤时将液体沿玻璃棒注入过滤器,并使液面高于滤纸边缘 | |
| D. | 漏斗下端紧靠烧杯内壁 |
12.三种无色溶液:石灰水、氢氧化钠溶液、稀硫酸,因标签脱落,若只选用一种试剂将它们加以鉴别,该试剂应选( )
| A. | 碳酸钠溶液 | B. | 酚酞试液 | C. | 石蕊试液 | D. | 氯化钡溶液 |
9.硝酸生产中,500℃时,NH3和O2可能发生如下反应:
①4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g)△H=-9072kJ•mol-1 K=1.1×1026
②4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g)△H=-1104.9kJ•mol-1 K=4,.4×1028
③4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g)△H=-1269.02kJ•mol-1 K=7,.1×1034
其中,②、③是副反应.若要减少副反应,提高单位时间内NO的产率,最合理的措施是( )
①4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g)△H=-9072kJ•mol-1 K=1.1×1026
②4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g)△H=-1104.9kJ•mol-1 K=4,.4×1028
③4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g)△H=-1269.02kJ•mol-1 K=7,.1×1034
其中,②、③是副反应.若要减少副反应,提高单位时间内NO的产率,最合理的措施是( )
| A. | 增大O2浓度 | B. | 使用合适的催化剂 | ||
| C. | 减小压强 | D. | 降低温度 |
16.CuO、Fe铁粉、Fe3O4的混合物中,加一定量稀H2SO4并微热,当反应停止后,滤出不溶物,并向溶液中插入一枚铁钉,片刻后.取出铁钉,发现铁钉并无变化,相据上述现象,确定下面结论中正确的是( )
| A. | 稀硫酸可能过量 | |
| B. | 不溶物中一定含有Fe | |
| C. | 不溶物中一定含有Cu,但不一定含有Fe | |
| D. | 滤液中一定含有Fe2(SO4)3,但不一定含有FeSO4 |
6.关于电解精炼铜的说法正确的是( )
| A. | 粗铜作阴极? | |
| B. | 用CuSO4作电解质溶液 | |
| C. | 阳极只发生Cu-2e-═Cu2+反应,其它杂质沉淀为阳极泥 | |
| D. | 电解质溶液的组成和浓度都不改变? |
10.分类是学习和研究中一种常用的方法,下列物质分类不正确的是( )
| A. | 生理盐水---混合物 | B. | 金刚石---单质 | ||
| C. | 冰-化合物 | D. | 纯碱-碱 |
3.实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程(Fe3+在pH=5时已完全沉淀):
下列分析正确的是( )

下列分析正确的是( )

| A. | 用98%的浓硫酸配制溶解所用的4.5 mol•L-1的稀硫酸,只需3种玻璃仪器 | |
| B. | 步骤②目的是将溶液Ⅰ中的Fe2+充分转化成Fe3+,实验操作是向溶液Ⅰ中通入足量的氯气 | |
| C. | 利用Cu(OH)2替代CuO也可调节溶液pH而不影响实验结果 | |
| D. | 步骤④之后的实验操作是蒸干溶剂结晶,所需仪器是蒸发皿、玻璃棒、酒精灯、泥三角、三脚架 |
 ,结构简式H2C=CH2.
,结构简式H2C=CH2. ,反应类型是加聚反应.
,反应类型是加聚反应. )与乙醇(
)与乙醇( )反应生成酯(
)反应生成酯( )和水的反应机理,反应过程中酸分子断裂C-O单键,醇分子断裂O-H键.试完成下列反应方程式:
)和水的反应机理,反应过程中酸分子断裂C-O单键,醇分子断裂O-H键.试完成下列反应方程式: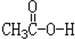 +CH3CH2-18O-H$\stackrel{一定条件}{→}$CH3CO18OCH2CH3+H2O.
+CH3CH2-18O-H$\stackrel{一定条件}{→}$CH3CO18OCH2CH3+H2O.