��Ŀ����
����Ŀ��ij��ɫ��ҵ��ˮ�п��ܺ���Na+��Mg2+��Al3+��Cl-��SO42-�еļ������ӡ�
a��ȡ�����÷�ˮ���Թ��У�����������Ba(NO3)2��Һ��ϡ���ᣬ������ɫ��������ַ�Ӧ����ˣ�����Һ�м���AgNO3��Һ����������
b����ȡ10mL�÷�ˮ���Թ��У��μ�NaOH��Һ�Ȳ�����ɫ�������ֳ����ܽ⡣���ɳ��������ʵ��������NaOH�����ʵ�����ϵ����ͼ��ʾ��
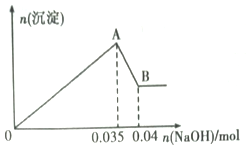
��������ʵ���ͼ�����ݣ�
��1���÷�ˮ��һ�������е�������______________________________(�����ӷ���)��
��2��д��A��B�����з�����Ӧ�����ӷ���ʽ��________________________��
��3���÷�ˮ�У�c(Al3+)=______________��
��4����ʵ��������100mL2mol/L��NaOH��Һʱ���õ��IJ����������ձ�������������Ͳ�⣬����Ҫ_________(����������)��
�����в���ʹ������ҺŨ��ƫ�����(��д��ĸ)_________��
A�������������������
B����NaOH����ֽ���ϳ���
C��NaOH���ձ����ܽ��δ��ȴ������ת�Ƶ�����ƿ��
D��������ƿת��ʱ��������Һ�����
E��δϴ���ܽ�NaOH���ձ�
F������ʱ���ӿ̶���
G������ƿδ���T����������Һ
���𰸡� Cl- Al(OH)3+OH-=AlO2-+H2O 0.5mol��L-1 100ml����ƿ����ͷ�ι� AC
��������ȡ�����÷�ˮ�ڹ��У�����������Ba(NO3)2��Һ��ϡ���ᣬ������ɫ�������ó���Ϊ���ᱵ����ԭ��Һ�к���SO42-����ַ�Ӧ����ˣ�����Һ�м���AgNO3��Һ����������˵��ԭ��Һ�в�����Cl-����ȡ10mL�÷�ˮ�ڹ��У��μ�NaOH��Һ�Ȳ�����ɫ�������ֳ����ܽ⣬�ܽ�ij���Ϊ�������������ܵij���Ϊ������þ����ԭ��Һ��һ������Mg2+��Al3+�������Ӳ���ȷ����
��1���������Ϸ�����֪�÷�ˮ��һ�������е�������Cl-����2��A��B�������������ܽ�����������Ӧ�����ӷ���ʽΪAl(OH)3+OH-=AlO2-+H2O����3�����ݷ�ӦAl(OH)3+OH-=AlO2-+H2O��֪n[Al(OH)3]=n(NaOH)=0.04mol��0.035mol=0.005mol�����������غ��֪ԭ��Һ�������ӵ����ʵ���Ϊ0.005mol����ԭ��Һ�������ӵ�Ũ��Ϊ��0.005mol��0.01L=0.5mol/L����4����ʵ��������100mL2mol/L��NaOH��Һʱ���õ��IJ����������ձ�������������Ͳ�⣬����Ҫ100ml����ƿ����ͷ�ιܡ���A������������������룬�������Ƶ��������ӣ�Ũ��ƫ�ߣ�B����NaOH����ֽ���ϳ���������������ˮ���������٣�Ũ��ƫ�ͣ�C��NaOH���ձ����ܽ��δ��ȴ������ת�Ƶ�����ƿ�У�������ȴ����Һ������٣�Ũ��ƫ�ߣ�D��������ƿת��ʱ��������Һ����������ʼ��٣�Ũ��ƫ�ͣ�E��δϴ���ܽ�NaOH���ձ������ʼ��٣�Ũ��ƫ�ͣ�F������ʱ���ӿ̶��ߣ���Һ������ӣ�Ũ��ƫ�ͣ�G������ƿδ���T����������Һ��Ӱ�죬��ѡAC��

 ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�
