题目内容
(10分)将1 mol氧气和一定量的HCl放入2L的密闭容器中,420℃时,在催化剂作用下发生反应:4HCl+O2 2Cl2+2H2O。5分钟后反应达到平衡,将容器中的混合气体通过过量NaOH溶液,消耗NaOH 2.0 mol;再将剩余气体干燥后通过焦性没食子酸的碱性溶液吸收O2,溶液增重19.2 g。
2Cl2+2H2O。5分钟后反应达到平衡,将容器中的混合气体通过过量NaOH溶液,消耗NaOH 2.0 mol;再将剩余气体干燥后通过焦性没食子酸的碱性溶液吸收O2,溶液增重19.2 g。
请回答下列问题:
(1)写出平衡时,混合气体通入NaOH溶液中所发生反应的离子方程式。
(2)计算0~5分钟时,Cl2的平均生成速率是多少。
(3)计算平衡时HCl的转化率。
 2Cl2+2H2O。5分钟后反应达到平衡,将容器中的混合气体通过过量NaOH溶液,消耗NaOH 2.0 mol;再将剩余气体干燥后通过焦性没食子酸的碱性溶液吸收O2,溶液增重19.2 g。
2Cl2+2H2O。5分钟后反应达到平衡,将容器中的混合气体通过过量NaOH溶液,消耗NaOH 2.0 mol;再将剩余气体干燥后通过焦性没食子酸的碱性溶液吸收O2,溶液增重19.2 g。请回答下列问题:
(1)写出平衡时,混合气体通入NaOH溶液中所发生反应的离子方程式。
(2)计算0~5分钟时,Cl2的平均生成速率是多少。
(3)计算平衡时HCl的转化率。
(10分)(1)H++OH-=H2O (2分) Cl2+OH-=Cl-+ClO-+H2O (2分)
(2) 0.08 mol?L-1?min-1 (3分) (3)80% (3分)
(2) 0.08 mol?L-1?min-1 (3分) (3)80% (3分)
略

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
 C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B)="0.200" mol/L及c(C)="0" mol/L。反应物A的浓度随时间的变化如下图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B)="0.200" mol/L及c(C)="0" mol/L。反应物A的浓度随时间的变化如下图所示。
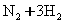

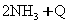 ,下列说法正确的是( )。
,下列说法正确的是( )。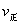 增大,
增大,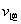 减小,所以平衡向右移动
减小,所以平衡向右移动
 2SO3(g),下列叙述正确的是
2SO3(g),下列叙述正确的是

 P如果温度每升高
P如果温度每升高 10℃,反应速率增加为原来的3倍。在10℃时完成反应的10%需要54min,将温度提高到400C完成反应的10%需要的时间为
10℃,反应速率增加为原来的3倍。在10℃时完成反应的10%需要54min,将温度提高到400C完成反应的10%需要的时间为 NH3(g) + HI(g)
NH3(g) + HI(g)