题目内容
【题目】催化剂在生产和科技领域起到重大作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

(1)定性如图甲可通过观察_____________,定性比较得出结论。同学X观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,其结论__________(填“合理”或“不合理”),理由是___________
(2)定量如图乙所示,实验时均以生成40 mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是_____________________。
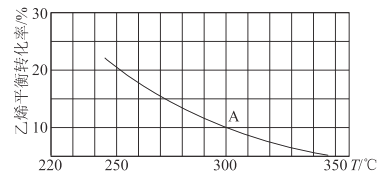
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
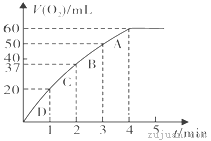
①实验时放出气体的总体积是__________mL。
②放出1/3气体所需时间为___________min。
③计算H2O2的初始物质的量浓度_______________。 (请保留两位有效数字)
④A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。
【答案】产生气泡的快慢 不合理 阴离子种类不同 产生40mL气体所需的时间 60 1 0.11mol/L D C B A
【解析】
(1)过氧化氢分解产生氧气,可以通过观察产生气泡的快慢来比较Fe3+和Cu2+对H2O2分解的催化效果,本实验采用的试剂阴离子不相同,则本实验设计有缺陷,不合理,故答案为:产生气泡的快慢;不合理;阴离子种类不同;
(2)可以通过测量产生40mL气体所需时间来比较Fe3+和Cu2+对H2O2分解的催化效果,时间越短,对应的离子催化效果越好,故答案为:产生40mL气体所需的时间;
(3)①由图可知,实验时放出气体的总体积是60mL,故答案为:60;
②放出1/3气体,即20mL气体用时1min,故答案为:1;
③产生O2的物质的量≈![]() ,
,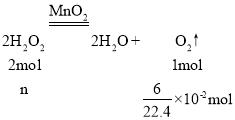 ,解得:n=
,解得:n=![]() ≈0.54mol,则H2O2的初始物质的量浓度=
≈0.54mol,则H2O2的初始物质的量浓度=![]() ≈0.11mol/L,故答案为:0.11mol/L;
≈0.11mol/L,故答案为:0.11mol/L;
④D、C、B、A斜率越来越小,则四个点反应速率减小,即A、B、C、D各点反应速率快慢的顺序为D>C>B>A,故答案为:D;C;B;A。

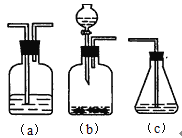
【题目】利用如图装置探究铜粉与下列试剂的反应,在试管中加入一定量铜粉,加入试剂后,立即塞上橡胶塞,实验现象如下表所示,下列推断不正确的是( )
资料:Cu2++4NH3![]() [Cu(NH3)4]2+, [Cu(NH3)4]2+呈绛蓝色。
[Cu(NH3)4]2+, [Cu(NH3)4]2+呈绛蓝色。
装置 | 序号 | 试剂 | 现象 |
| ① | 10 mL浓NH3·H2O,3 mLH2O | 溶液变为绛蓝色,左侧水柱上升 |
② | 10 mL浓NH3·H2O,3 mL H2O2 | 溶液变为绛蓝色,且比①深 | |
③ | 10 mL 20% HNO3溶液,3 mL H2O | 溶液快速变蓝,产生无色气体,左侧水柱下降 | |
④ | 10 mL 20% HNO3溶液,3 mL H2O2 | 溶液变蓝比③慢,产生无色气体,左侧水柱下降 |
A.①中实验现象说明O2参与了反应
B.②中溶液颜色比①深可能是由于H2O2氧化Cu生成Cu2+
C.③中左侧水柱下降可能是反应产生NO气体导致的
D.④比③变蓝慢是由于H2O2分解造成自身消耗
【题目】在密闭容器中发生下列反应:I2(g)+H2(g)![]() 2HI(g)(正反应为放热反应)。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变填入相关的表格中(填“增大”“减小”或“不变”)。
2HI(g)(正反应为放热反应)。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变填入相关的表格中(填“增大”“减小”或“不变”)。
编号 | 改变的条件 | 反应速率 |
(1) | 升高温度 | ______ |
(2) | 加入正催化剂 | ______ |
(3) | 再充入a mol H2 | ______ |
(4) | 将容器的容积扩大到原来的2倍 | ______ |
(5) | 保持容积不变,通入b mol Ne | ______ |