题目内容
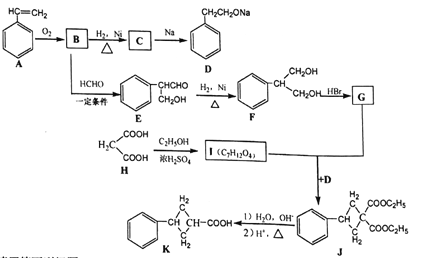
【题目】25℃时,用pH计测量VmL0.1mol·L-1NaOH溶液中逐滴滴加等浓度的一元酸HA后pH的变化情况,绘制pH变化曲线如图所示,下列说法不正确的是( )
A. A点溶液的pH=13
B. B和C两点所示溶液中水的电离程度:B>C
C. pH=7时,溶液中存在:c(Na+)=c(H+)+(HA)
D. C点所示溶液中离子浓度大小顺序:c(A-)>c(Na+)>c(H+)>c(OH-)
【答案】C
【解析】A. A点所示的溶液中c(NaOH)=0.1mol·L-1,溶液的pH=13,故A正确;B. B点所示溶液中的A-水解,促进了水的电离,C点所示溶液中弱酸HA电离出的H+抑制了水的电离,所以B和C两点所示溶液中水的电离程度:B>C,故B正确;C. pH=7时, c(H+)=c(OH-),根据电荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-)可知,c(Na+)=c(A-),故C错误;D. C点所示溶液中c(NaA)=c(HA),由溶液呈酸性可知HA的电离程度大于A-的水解程度,则离子浓度大小顺序为: c(A-)>c(Na+)>c(H+)>c(OH-),故D正确;答案选C。

【题目】二氧化氯气体有毒,常应用在果蔬保鲜方面,用NaClO3与CH3OH (沸点64.7℃) 在催化剂、61℃时发生反应得到ClO2,实验装置如下图,(已知ClO2 的稳定性较差,用稳定剂吸收ClO2。使用时加酸释放出ClO2)。完成下列填空:

(1)仪器b的名称为________,其作用是_____________。
(2)反应中甲醇被氧化为甲酸(HCOOH),写出制备ClO2的化学方程式____________________。
(3)甲装置中采取的加热方式是________________,如果滴加甲醇的速度过快,可造成的后果____________。
(4)某同学建议将上述装置中的分液漏斗c改为恒压漏斗,你认为他的理由是______________________。
(5)实验结束后,先用仪器a 注入一定量的NaOH溶液,过一段时后再拆卸仪器,其目的是____________。
(6)下表是两种稳定剂加酸后释放ClO2的浓度随时间的变化数据,若将其用于樱桃保鲜,你认为效果较好的稳定剂是_______( 填"1”或“2”),原因是________________________________。
时间/天 稳定剂 | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
稳定剂1 | 80 | 150 | 80 | 20 | 10 | 5 | 0 | 0 | 0 |
稳定剂2 | 40 | 52 | 52 | 52 | 52 | 50 | 48 | 47 | 20 |
(7)某同学在实验室测定某保鲜剂中ClO2含量,其实验操作如下,在维形瓶中加入足量的KI溶液。再加入5mL稀硫酸,取15ml保鲜剂于锥形瓶中。ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+==2C1-+5I2+4H2O;用0.1000 mol/L Na2S2O3标准溶液滴定碘单质(I2+2S2O32-=2I-+S4O62-) 。达到滴定终点时用去18.00mlNa2S2O3标准溶液,测得该保鲜剂中ClO2的含量为________g·L-1
【题目】亚硝酸钠(NaNO2)是一种重要的化工原料,某学习小组通过下述实验制备亚硝酸钠,并测定所制备亚硝酸钠的纯度。
(一)利用下列装置制备NaNO2。
已知:①2NO+Na2O2=2NaNO2;② NO和NO2-均能被酸性高锰酸钾氧化为NO3-。

(1)选择上述仪器完成实验,其连按顺序为_______________(按气流方向,用小写字母表示)。
(2)装置A中m管的作用为_________________。
(3)装置B中发生反应的离子方程式为____________________________________________________。
(二)测定上述实验所制备的NaNO2样品(含NaNO3和Na2CO3 杂质)的纯度。
称量D中所得样品ag溶解后配制成250 mL 溶液,取25.00mL于锥形瓶用6mol·L-1 的酸性高锰酸钾溶液滴定到终点;重复上述滴定操作两次,测得数据如下表:
第一次 | 第二次 | 第三次 | |
酸性高锰酸钾溶液休积/mL | 19.98 | 19.75 | 20.02 |
(4)盛装酸性高锰酸钾溶液前需对酸式滴定管进行的操作为__________________________。
(5)滴定到终点的实验现象为_________________________________________________。
(6)下列实验操作可能导致出现上表中第二次实验数据的是________(填字母编号)。
a.滴定时有部分酸性高锰酸钾溶液滴在锥形瓶外
b.加入样品溶液前的锥形瓶未经干燥
c.滴定前仰视读数,滴定后俯视读数
(7)最终所得样品中NaNO2 的质量分数为_____________(用含a、b的关系式表示)。