题目内容
【题目】五氧化二钒![]() 在冶金、化工等领域有重要应用。实验室以含钒废料
在冶金、化工等领域有重要应用。实验室以含钒废料![]() 含
含![]() 、CuO、MnO、
、CuO、MnO、![]() 、
、![]() 、有机物
、有机物![]() 为原料制备
为原料制备![]() 的一种流程如下:
的一种流程如下:

已知:![]() 时,难溶电解质的溶度积常数如表所示:
时,难溶电解质的溶度积常数如表所示:
难溶电解质 |
|
|
|
|
|
|
|
(1)“焙烧”的目的是____________________________________________;
(2)“滤渣1”的用途为____________![]() 写出一种即可
写出一种即可![]() ;常温下,若“调pH”为7,
;常温下,若“调pH”为7,![]() 是否能沉淀完全:______
是否能沉淀完全:______![]() 填“是”或“否”
填“是”或“否”![]() ;
;![]() 溶液中离子浓度小于
溶液中离子浓度小于![]() 时,认为该离子沉淀完全
时,认为该离子沉淀完全![]()
(3)“沉锰”需将温度控制在![]() 左右,温度不能过高或过低的原因为_______________;
左右,温度不能过高或过低的原因为_______________;
(4)结晶所得的![]() 需进行水洗、干燥。证明
需进行水洗、干燥。证明![]() 已洗涤干净的实验操作及现象为_______________________;
已洗涤干净的实验操作及现象为_______________________;
(5)在煅烧![]() 生成
生成![]() 的过程中,固体残留率
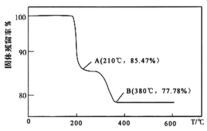
的过程中,固体残留率![]() 随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是_________、____________。
随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是_________、____________。![]() 填写分子式
填写分子式![]()
(6)为测定该产品的纯度,兴趣小组同学准确称取![]() 产品
产品![]() ,加入足量稀硫酸使其完全反应,生成
,加入足量稀硫酸使其完全反应,生成![]() ,并配成
,并配成![]() 溶液。取
溶液。取![]() 溶液用
溶液用![]() 的
的![]() 标准溶液滴定,滴定到终点时消耗标准液
标准溶液滴定,滴定到终点时消耗标准液![]() 。已知滴定过程中
。已知滴定过程中![]() 被氧化为
被氧化为![]() ,
,![]() 黄色
黄色![]() 被还原为
被还原为![]() 蓝色
蓝色![]() ,该反应的离子方程式为_____________;该产品的纯度为_________________。
,该反应的离子方程式为_____________;该产品的纯度为_________________。
【答案】除去有机物杂质,将![]() 氧化为
氧化为![]() 制光导纤维、制玻璃、制硅胶等 是 温度过低,反应速率慢,
制光导纤维、制玻璃、制硅胶等 是 温度过低,反应速率慢,![]() 可能提前结晶析出导致产率低,温度过高,
可能提前结晶析出导致产率低,温度过高,![]() 分解,导致原料利用率低 取少量最后一次洗涤液于洁净的试管中,滴加
分解,导致原料利用率低 取少量最后一次洗涤液于洁净的试管中,滴加![]() 溶液,无明显现象,证明
溶液,无明显现象,证明![]() 已洗涤干净
已洗涤干净 ![]()
![]()
![]()
![]() 。
。
【解析】
含钒废料![]() 含
含![]() 、CuO、MnO、
、CuO、MnO、![]() 、
、![]() 、有机物
、有机物![]() 焙烧后,有机物杂质会燃烧除去,
焙烧后,有机物杂质会燃烧除去,![]() 被氧化为
被氧化为![]() ;“滤渣1”为不与硫酸反应的二氧化硅,剩余含有Cu2+,Mn2+, Al3+和钒离子,调节PH将杂质离子生成难溶物除去,碳酸氢铵除锰,剩余物质
;“滤渣1”为不与硫酸反应的二氧化硅,剩余含有Cu2+,Mn2+, Al3+和钒离子,调节PH将杂质离子生成难溶物除去,碳酸氢铵除锰,剩余物质![]() 煅烧得到
煅烧得到![]() 。
。
(2)利用氢氧化铜的溶度积公式计算出铜离子的浓度,与10—5比较,小于10—5,则沉淀完全;
(3)“沉锰”时所用试制为NH4 HCO3温度过低时,反应速率较慢.,NH4VO3可能提前结晶析出,导致产率较低;温度过高时. NH4 HCO3分解使原料的利用率降低,并导致环境污染;
(4)NH4VO3晶体可能粘附HCO3-,SO42-等,故加入氯化钡溶液;
(5)由图像上不同温度下的固体残留率,得到失去的物质;
(6)根据实验现象写出离子方程式,根据离子方程式计算得出产率。
(1)由含钒废料的成分和流程图中物质的转化关系知,“焙烧"的目的是除去有机物杂质,并将![]() 氧化为
氧化为![]() ,故答案为:除去有机物杂质,将
,故答案为:除去有机物杂质,将![]() 氧化为
氧化为![]() ;
;
(2) “滤渣1”为二氧化硅,可用于制作光导纤维,玻璃,制取硅胶,硅单质等,由流程图中信息知,“调pH”的目的是将Cu2+转化为Cu(OH)2沉淀,调节pH为7时,溶液中c(H+)=10-7 mol./L ,c(OH-)=![]() mol/L=
mol/L=![]() =10-7mol/L,c(Cu2+)=
=10-7mol/L,c(Cu2+)=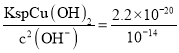 =2.2×10-6<10-5,故沉淀完全,故答案为:制光导纤维、制玻璃、制硅胶等;是;
=2.2×10-6<10-5,故沉淀完全,故答案为:制光导纤维、制玻璃、制硅胶等;是;
(3)“沉锰”时所用试制为NH4 HCO3温度过低时,反应速率较慢,NH4VO3可能提前结晶析出,导致产率较低;退度过高时, NH4 HCO3分解使原料的利用率降低,并导致环境污染,故答案为:温度过低,反应速率慢,![]() 可能提前结晶析出导致产率低,温度过高,
可能提前结晶析出导致产率低,温度过高,![]() 分解,导致原料利用率低;
分解,导致原料利用率低;
(4)NH4VO3晶体可能粘附HCO3-,SO42-等,故证明NH4VO3已洗涤干净的实验操作及现象为:取少量最后一次洗涤液于洁净试管中,滴加![]() 溶液,无明显现象,证明
溶液,无明显现象,证明![]() 已洗涤干净,故答案为:取少量最后一次洗涤液于洁净试管中, 滴加
已洗涤干净,故答案为:取少量最后一次洗涤液于洁净试管中, 滴加![]() 溶液,无明显现象,证明
溶液,无明显现象,证明![]() 已洗涤干净 ;
已洗涤干净 ;
(5)解析NH4VO3 分解的过程中生成氨气和HVO3,210![]() 时若分解生成酸和氨气,假设起始NH4VO3的质量为117g,则剩余固体占起始固体百分含量为
时若分解生成酸和氨气,假设起始NH4VO3的质量为117g,则剩余固体占起始固体百分含量为![]() ≈85.47%, 所以210
≈85.47%, 所以210![]() 时,剩余固体物质的化学式为HVO3,失去的物质为NH3,380
时,剩余固体物质的化学式为HVO3,失去的物质为NH3,380![]() 时,HVO3进一步分解生成V2O5和水,则剩余固体占起始固体百分含量为
时,HVO3进一步分解生成V2O5和水,则剩余固体占起始固体百分含量为![]() =77.78%,故剩余固体是V2O5,失去的物质为H2O,故答案为:
=77.78%,故剩余固体是V2O5,失去的物质为H2O,故答案为:![]() ;
;![]() ;
;
(6)已知滴定过程中![]() 被氧化为
被氧化为![]() ,img src="http://thumb.zyjl.cn/questionBank/Upload/2020/11/27/00/8bf063d5/SYS202011270026294950861831_DA/SYS202011270026294950861831_DA.022.png" width="41" height="25" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />黄色
,img src="http://thumb.zyjl.cn/questionBank/Upload/2020/11/27/00/8bf063d5/SYS202011270026294950861831_DA/SYS202011270026294950861831_DA.022.png" width="41" height="25" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />黄色![]() 被还原为
被还原为![]() 蓝色
蓝色![]() ,则离子方程式为
,则离子方程式为![]() ;准确称取产品V2O52.0g,加入足量的稀硫酸使其完全生成(VO2)2SO4,并配成250mL溶液。取25.00mL溶液用0.1000mol/L的H2C2O4溶液滴定,消耗标准液10.00mL,已知离子方程式为
;准确称取产品V2O52.0g,加入足量的稀硫酸使其完全生成(VO2)2SO4,并配成250mL溶液。取25.00mL溶液用0.1000mol/L的H2C2O4溶液滴定,消耗标准液10.00mL,已知离子方程式为![]() ,则n(VO2+)=2n(H2C2O4)=2×0.01L×0.1000mol/L,所以250mL溶液中n(VO2+)=2×0.01L×0.1000mol/L×
,则n(VO2+)=2n(H2C2O4)=2×0.01L×0.1000mol/L,所以250mL溶液中n(VO2+)=2×0.01L×0.1000mol/L×![]() =0.02mol,所以n(V2O5)=0.01mol,其质量为0.01mol×182g/mol=1.82g,所以产品的纯度为
=0.02mol,所以n(V2O5)=0.01mol,其质量为0.01mol×182g/mol=1.82g,所以产品的纯度为![]() ×100%=91.00%,故答案为:
×100%=91.00%,故答案为:![]() ;91.00%。
;91.00%。

【题目】根据下列实验操作和现象能得出相应结论的是
选项 | 实验操作 | 现象 | 结论 |
A | 将 | 溶液红色褪去 |
|
B | 分别向盛有 | a中溶液变蓝,b中产生黄色沉淀 |
|
C | 向淀粉溶液中加入稀硫酸并加热,再加入银氨溶液,水浴加热 | 未见有银镜产生 | 淀粉没有水解 |
D | 向无水乙醇中加入浓硫酸,加热,产生的气体通入酸性 | 溶液紫色褪去 | 气体中含有乙烯 |
A.AB.BC.CD.D