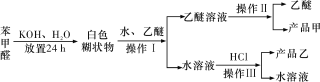
题目内容
【题目】关于如图中各装置的叙述正确的是( )
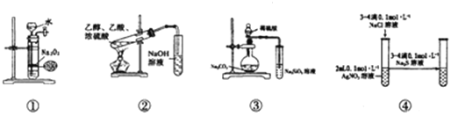
A.装置①可制备少量氧气
B.装置②可用于实验室制取和收集乙酸乙酯
C.装置③的实验可推断硫、碳、硅三种元素的非金属强弱
D.装置④能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
【答案】C
【解析】
A.过氧化钠为粉末状,且与水反应剧烈,不能控制反应,A错误;
B.乙酸乙酯在氢氧化钠溶液中可完全水解,应用饱和碳酸钠溶液,B错误;
C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,根据反应现象,硫酸与碳酸钠反应生成二氧化碳,二氧化碳通入硅酸钠溶液中生成硅酸,可比较非金属性强弱,C正确;
D.硝酸银过量,加入硫化钠后肯定生成Ag2S沉淀,不能证明AgCl和Ag2S的溶解度大小,D错误。
故选:C。

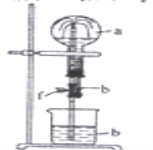
【题目】在如图装置中,烧瓶中充满干燥气体a。将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶。a和b可能是( )
a(干燥气体) |
| |
① | NH3 | 水 |
② | CO2 | 饱和NaOH溶液 |
③ | Cl2 | 饱和食盐水 |
④ | NO2 | 水 |
⑤ | HCl | 0.1 mol·L1AgNO3溶液 |
A. ①②③B. ①②⑤C. ②④⑤D. ①②④
【题目】五氧化二钒![]() 在冶金、化工等领域有重要应用。实验室以含钒废料
在冶金、化工等领域有重要应用。实验室以含钒废料![]() 含
含![]() 、CuO、MnO、
、CuO、MnO、![]() 、
、![]() 、有机物
、有机物![]() 为原料制备
为原料制备![]() 的一种流程如下:
的一种流程如下:

已知:![]() 时,难溶电解质的溶度积常数如表所示:
时,难溶电解质的溶度积常数如表所示:
难溶电解质 |
|
|
|
|
|
|
|
(1)“焙烧”的目的是____________________________________________;
(2)“滤渣1”的用途为____________![]() 写出一种即可
写出一种即可![]() ;常温下,若“调pH”为7,
;常温下,若“调pH”为7,![]() 是否能沉淀完全:______
是否能沉淀完全:______![]() 填“是”或“否”
填“是”或“否”![]() ;
;![]() 溶液中离子浓度小于
溶液中离子浓度小于![]() 时,认为该离子沉淀完全
时,认为该离子沉淀完全![]()
(3)“沉锰”需将温度控制在![]() 左右,温度不能过高或过低的原因为_______________;
左右,温度不能过高或过低的原因为_______________;
(4)结晶所得的![]() 需进行水洗、干燥。证明
需进行水洗、干燥。证明![]() 已洗涤干净的实验操作及现象为_______________________;
已洗涤干净的实验操作及现象为_______________________;
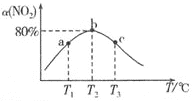
(5)在煅烧![]() 生成
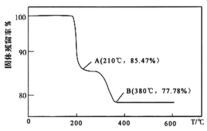
生成![]() 的过程中,固体残留率
的过程中,固体残留率![]() 随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是_________、____________。
随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是_________、____________。![]() 填写分子式
填写分子式![]()
(6)为测定该产品的纯度,兴趣小组同学准确称取![]() 产品
产品![]() ,加入足量稀硫酸使其完全反应,生成
,加入足量稀硫酸使其完全反应,生成![]() ,并配成
,并配成![]() 溶液。取
溶液。取![]() 溶液用
溶液用![]() 的
的![]() 标准溶液滴定,滴定到终点时消耗标准液
标准溶液滴定,滴定到终点时消耗标准液![]() 。已知滴定过程中
。已知滴定过程中![]() 被氧化为
被氧化为![]() ,
,![]() 黄色
黄色![]() 被还原为
被还原为![]() 蓝色
蓝色![]() ,该反应的离子方程式为_____________;该产品的纯度为_________________。
,该反应的离子方程式为_____________;该产品的纯度为_________________。