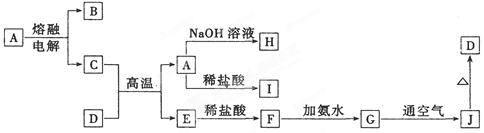
题目内容
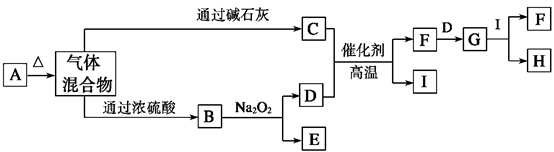
A、B、C、D、E为中学化学常见的单质或化合物,其相互转化关系如下图所示。

(1)若A为短周期常见金属单质,B、C均为含A元素的盐,且B溶液的pH>7,C溶液pH<7。用离子方程式表示B溶液pH>7的原因 ;
(2)若A是淡黄色化合物;常温下D是无色气体;C为常见强碱,含有的阴、阳离子均为10电子粒子。
① C中所含化学键的类型是 ;
②写出反应I的化学方程式 ;
③将一定量的气体D通入2 L C的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:O点溶液中所含溶质的化学式为 ,a点溶液中各离子浓度由大到小的顺序是 。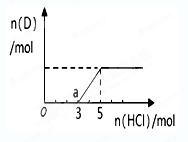

(1)若A为短周期常见金属单质,B、C均为含A元素的盐,且B溶液的pH>7,C溶液pH<7。用离子方程式表示B溶液pH>7的原因 ;
(2)若A是淡黄色化合物;常温下D是无色气体;C为常见强碱,含有的阴、阳离子均为10电子粒子。
① C中所含化学键的类型是 ;
②写出反应I的化学方程式 ;
③将一定量的气体D通入2 L C的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:O点溶液中所含溶质的化学式为 ,a点溶液中各离子浓度由大到小的顺序是 。

(1)AlO2 - + 2H2O Al(OH)3 + OH -
Al(OH)3 + OH -
(2)①离子键和共价键 ②2Na2O2+2CO2==2Na2CO3+O2
③NaOH和 Na2CO3 , c(Na+)>c(Cl-) >c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。
 Al(OH)3 + OH -
Al(OH)3 + OH -(2)①离子键和共价键 ②2Na2O2+2CO2==2Na2CO3+O2
③NaOH和 Na2CO3 , c(Na+)>c(Cl-) >c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。
(1)根据已知条件可知,A是铝,D是氢氧化钠,B是偏铝酸钠,C是氯化铝,E是盐酸。膦甲酸钠由于AlO2-水解显碱性,方程式为AlO2 - + 2H2O Al(OH)3 + OH -。
Al(OH)3 + OH -。
(2)①淡黄色化合物是过氧化钠,即A是过氧化钠,则D是CO2,B是碳酸钠,C是氢氧化钠。氢氧化钠是含有离子键和极性键的离子化合物。
②过氧化钠和CO2反应的方程式为2Na2O2+2CO2==2Na2CO3+O2。
③由于碳酸钠和氯化氢反应是分布进行的,根据图像可知,生成CO2消耗的氯化氢小于o→a反应消耗的氢氧化钠,这说明o点含有的溶质是氢氧化钠和碳酸钠。A点恰好是碳酸氢钠,由于碳酸氢钠的水解程度大于电离程度,溶液显碱性,所以溶液中各离子浓度由大到小的顺序是c(Na+)>c(Cl-) >c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。
 Al(OH)3 + OH -。
Al(OH)3 + OH -。(2)①淡黄色化合物是过氧化钠,即A是过氧化钠,则D是CO2,B是碳酸钠,C是氢氧化钠。氢氧化钠是含有离子键和极性键的离子化合物。
②过氧化钠和CO2反应的方程式为2Na2O2+2CO2==2Na2CO3+O2。
③由于碳酸钠和氯化氢反应是分布进行的,根据图像可知,生成CO2消耗的氯化氢小于o→a反应消耗的氢氧化钠,这说明o点含有的溶质是氢氧化钠和碳酸钠。A点恰好是碳酸氢钠,由于碳酸氢钠的水解程度大于电离程度,溶液显碱性,所以溶液中各离子浓度由大到小的顺序是c(Na+)>c(Cl-) >c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。

练习册系列答案
相关题目


 (1)A、F的化学式分别为 、 。?
(1)A、F的化学式分别为 、 。?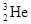 可以作为核聚变材料,下列关于
可以作为核聚变材料,下列关于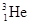 互为同位素
互为同位素