题目内容
(2011?四川二模)常温下,对于①0.2mol/L氨水②0.05mol/L盐酸③pH=13的NaOH溶液④0.1mol/L AlCl3溶液,下列说法正确的是( )
分析:A.①与②混合,无论①是否过量,溶液中一定存在NH4+、Cl-、OH-、H+;
B.③与④以体积比1:4混合,生成Al(OH)3沉淀;
C.②与③以体积比3:2混合,碱过量,溶液呈碱性;
D.②与④以体积比2:1混合,根据溶液电中性结合物料守恒计算.
B.③与④以体积比1:4混合,生成Al(OH)3沉淀;
C.②与③以体积比3:2混合,碱过量,溶液呈碱性;
D.②与④以体积比2:1混合,根据溶液电中性结合物料守恒计算.
解答:解:A.①与②混合,无论①是否过量,溶液中一定存在NH4+、Cl-、OH-、H+,故A错误;
B.③与④以体积比1:4混合,AlCl3溶液过量,得到Al(OH)3沉淀,不是胶体,故B错误;
C.②与③以体积比3:2混合,则c(OH-)=
=0.01mol/L,pH=12,故C错误;
D.②与④以体积比2:1混合,设体积分别为2L和1L,则n(HCl)=0.1mol,n(AlCl3)=0.1mol,
n(Cl-)=0.4mol,溶液中存在Al3++3H2O Al(OH)3+3H+,则n(Al3+)+n(Al(OH)3)=0.1mol,
Al(OH)3+3H+,则n(Al3+)+n(Al(OH)3)=0.1mol,
则有c(Cl-)=4[c(Al3+)+c(Al(OH)3)],
又溶液中存在:3c(Al3+)+c(H+)=c(Cl-)+c(OH-)
3c(Al3+)+c(H+)=4[c(Al3+)+c(Al(OH)3)]+c(OH-)
则有c(H+)=c(Al3+)+4c[Al(OH)3]+c(OH-),故D正确.
故选D.
B.③与④以体积比1:4混合,AlCl3溶液过量,得到Al(OH)3沉淀,不是胶体,故B错误;
C.②与③以体积比3:2混合,则c(OH-)=
| 0.1mol/L×2V-0.05moL/L×3V |
| 2V+3V |
D.②与④以体积比2:1混合,设体积分别为2L和1L,则n(HCl)=0.1mol,n(AlCl3)=0.1mol,
n(Cl-)=0.4mol,溶液中存在Al3++3H2O
 Al(OH)3+3H+,则n(Al3+)+n(Al(OH)3)=0.1mol,
Al(OH)3+3H+,则n(Al3+)+n(Al(OH)3)=0.1mol,则有c(Cl-)=4[c(Al3+)+c(Al(OH)3)],
又溶液中存在:3c(Al3+)+c(H+)=c(Cl-)+c(OH-)
3c(Al3+)+c(H+)=4[c(Al3+)+c(Al(OH)3)]+c(OH-)
则有c(H+)=c(Al3+)+4c[Al(OH)3]+c(OH-),故D正确.
故选D.
点评:本题考查酸碱混合的定性判断和离子浓度的大小比较,题目难度较大,注意物质的物质的量之间的关系,从盐类的水解结合溶液的电荷守恒、物料守恒进行判断.

练习册系列答案
相关题目
 (其中R为饱和烃基),A在一定条件下有如图所示的转化关系.已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2.
(其中R为饱和烃基),A在一定条件下有如图所示的转化关系.已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2.





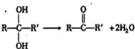 ,对于某有机物
,对于某有机物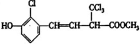 下列说法正确的是( )
下列说法正确的是( )