题目内容
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_____________,K值大小与温度的关系是:温度升高,K值______________(填“一定增大”、“一定减小”、或“可能增大也可能减小”)。
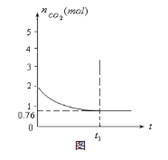
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g) 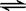 CO2(g)十H2 (g) △H < 0 ;CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)
CO2(g)十H2 (g) △H < 0 ;CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)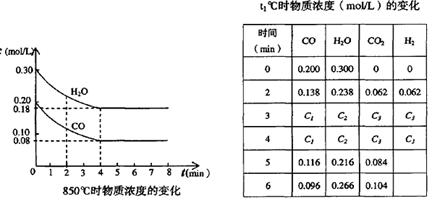
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min—4min之间反应处于_________状态; C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4min—5min问,平衡向逆方向移动,可能的原因是________(单选), 表中5min—6min之间数值发生变化,可能的原因是__________(单选)。
| A.增加水蒸气 | B.降低温度 |
| C.使用催化剂 | D.增加氢气浓度 |
(每空2分,共14分)(1) 可逆反应的进行程度越大 可能增大也可能减小
(2) 0.03 (3) ① 平衡 大于 ② D ; A
解析试题分析:(1)化学平衡常数K表示可逆反应的进行程度,依据平衡常数含义可知,K值越大,可逆反应的进行程度越大;温度升高,平衡向吸热反应方向进行,反应可能是吸热反应,也可能是放热反应,所以温度升高,平衡常数可能增大也可能减小;
(2)0-4min可知,△c=0.2mol/L-0.08mol/L=0.12mol/L,则v(CO)=△c/△t="(0.12/4)mol/(L·" min)="0.03" mol/(L· min);
(3)①表中3min-4min之间各物质的浓度不变,达到平衡状态,该反应为放热反应,升高温度逆向移动,c(CO)>0.08mol/L;
②C1>0.08mol/L,则C3<0.12mol/L,C2>0.18mol/L,4min-5min之间,平衡向逆方向移动,二氧化碳的浓度降低,一氧化碳和水蒸气的浓度都增大,所以改变的条件是增大氢气的浓度;5min-6min之间,一氧化碳浓度减小,水蒸气和二氧化碳浓度增大,平衡向正反应方向移动,则改变的条件是增大水蒸气的浓度;故选D,A。
考点:本题考查的是物质的量和浓度随时间变化曲线图、化学平衡及其影响因素。

工业上制备H2的一种重要方法是: CO(g) + H2O(g)  CO2 (g) + H2(g) △H=Q kJ/mol 。已知该反应的平衡常数K与温度T的关系如图所示。若在一固定的密闭容器中, 850℃ 时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:
CO2 (g) + H2(g) △H=Q kJ/mol 。已知该反应的平衡常数K与温度T的关系如图所示。若在一固定的密闭容器中, 850℃ 时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:
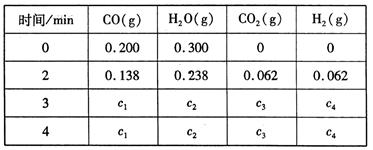
已知:850℃ 时该反应的化学平衡常数K ="1.0" ,请回答下列问题:
(1)Q 0(填“ > ”、“ = ”或“<” )。
(2)可以判断该反应达到化学平衡状态的叙述是 (填字母)。
| A.单位时间内减少 CO(g)的浓度等于生成 CO2 (g)的浓度 |
| B.反应容器内的压强不发生变化 |
| C.混合气体中 H2 (g)的浓度不再发生改变 |
| D.氢气的生成速率等于水的生成速率 |
(4)上表中 c2为 mol/L , CO(g)的转化率为
某温度下,将2mol A和2.8 mol B充入体积为2 L的恒容密闭容器中,发生如下反应:
aA(g)+B(g) 2C(g)+ D(s) ,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。
2C(g)+ D(s) ,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。
(1) 5 min内用B表示该反应的化学反应速率为 。
(2)该温度下,此可逆反应的逆反应的平衡常数为 。
(3)a的值为 。
(4)下列说法一定能说明上述反应已达到平衡状态的是 。
①单位时间里每生成1molB的同时消耗了2mol的C ②D的物质的量不再变化
③混合气体的密度不再变化 ④混合气体的平均相对分子质量不再变化
⑤体系的压强不再变化
(5)该温度下,某同学设计了以下实验,请在空格中填入热量(含Q的表达式表示)
| 起始 n(A)/mol | 起始 n(B)/mol | 起始 n(C)/mol | 起始 n(D)/mol | 达到平衡时放出(或吸收)的热量 |
| 0 | 1.6 | 8 | 足量 | |
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
(1)已知: ①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 =" +" 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 =" +" 172.5 kJ mol-1
则a = kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
① 甲容器中CO的平衡转化率为 。
② 下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
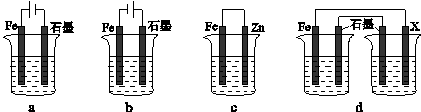
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a-c装置中,能保护铁的是 (填字母)。
②若用d装置保护铁,X极的电极材料应是 (填名称)。
工业制硝酸的主要反应是:4NH3(g)+5O2(g) 4NO(g)+6H2O (g) ΔH=" -1025" KJ/mol
4NO(g)+6H2O (g) ΔH=" -1025" KJ/mol
(1)一定温度下,现将0.8mol NH3和1.5mol O2充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 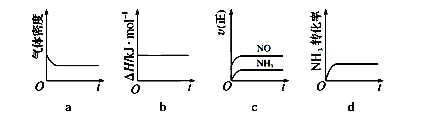
(2)在容积为1L的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.5 | 0 |
| 第2min | 0.7 | a | 0.1 |
| 第4min | 0.4 | 1.0 | 0.4 |
| 第6min | 0.4 | 1.0 | 0.4 |
| 第8min | 1.2 | 2.5 | 0.4 |
①起始时物料比c (O2) : c (NH3)>1.25,其原因是
②反应在第2min到第4min时O2的平均反应速率为 mol·L-1·min-1
③反应在第2min改变了反应条件,改变的条件可能是 (填字母序号)
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是 ,再次达到平衡时,NO的体积分数
(填“增大”、“减小”或“不变”)
在T℃时,向1 L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g)  aZ(g)+W(g) ΔH=-Q kJ/mol(Q>0);该反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小。
aZ(g)+W(g) ΔH=-Q kJ/mol(Q>0);该反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小。
请回答下列问题:
(1)化学计量数a的值为________。
(2)下列能说明该反应达到了化学平衡状态的是________(填序号)。
a.容器内压强一定
b.容器内气体的密度一定
c.容器内Z的分子数一定
d.容器内气体的质量一定
(3)维持T℃温度不变,若起始时向容器M中加入2 mol X、1 mol Y和1 mol Ar(稀有气体不参与反应),则反应达到平衡后放出的热量是________kJ。
(4)维持T℃温度不变,若在一个和原容器体积相等的恒压容器N中加入2 mol X和1 mol Y,发生题给反应并达到平衡,则________(填“M”或“N”)容器中的反应先达到平衡状态,容器中X的质量分数M________N(填“>”、“<”或“=”)。
(5)已知:该反应的平衡常数随温度的变化情况如表所示:
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
若在某温度下,2 mol X和1 mol Y在容器M中反应并达到平衡,X的平衡转化率为50%,则该温度为________℃。
(6)维持T℃温度不变,若起始时向容器M中加入4 mol X和6 mol Y,反应达到平衡时容器内的分子数目减少10%,则反应中放出的热量为________kJ。
(16分)工业上可以在恒容密闭容器中采用下列反应制备甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)下列情况可以作为判断反应达到平衡状态的依据的是(填序号) 。
A.生成CH3OH 的速率与消耗H2的速率之比为1︰2
B.混合气体的平均相对分子质量保持不变
C.混合气体的密度保持不变
D.体系内的压强保持不变
(2)下表所列数据为该反应在不同温度下的化学平衡常数:
| 温度/℃ | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
①反应的平衡常数表达式为K= 。由上表数据判断,该反应的△H 0(填“>”、“=”或“<”)。升高温度,正反应速率 (填“增大”、“减小”或“不变”)。
②某温度下,将2molCO和6molH2充入一个容积为2L的密闭容器中,达到平衡时c(H2)=1.4mol/L,则CO的转化率为 ,此时的温度为 。
(3)欲提高CO的转化率,可采取的措施是 。(填序号)
A.升温
B.加入更高效的催化剂
C.恒容条件下充入CO
D.恒容条件下充入H2
E.恒容条件下充入氦气
F.及时移走CH3OH
(4)一定条件下,CO和H2在催化剂作用下生成1molCH3OH的能量变化为90.8kJ。该温度下,在三个容积相同的密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 | |
| 投料方式 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平衡数据 | C(CH3OH)/(mol/L) | c1 | c2 | c3 |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 原料转化率 | α1 | α2 | α3 | |
下列分析正确的是 。(填序号)
A.2c1<c3 B.2 p1<p3 C.|a|+|b|=90.8 D.α1+α3>1
 2CO(g) △H>0
2CO(g) △H>0