��Ŀ����
����Ŀ��ʵ���ҿ��ù������������Ũ�����ڼ�����������ȡ��������ѧ����ʽΪMnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O����֪Ũ�����ӷ���ijѧ���������ͼ��ʾ��ʵ��װ�ã����������볱ʪ����ʯ�ҷ�Ӧ��ȡ����Ư��(����һ�����ȷ�Ӧ)���ش��������⣺
MnCl2+Cl2��+2H2O����֪Ũ�����ӷ���ijѧ���������ͼ��ʾ��ʵ��װ�ã����������볱ʪ����ʯ�ҷ�Ӧ��ȡ����Ư��(����һ�����ȷ�Ӧ)���ش��������⣺

(1)Aװ��Ϊʵ������ȡ������װ�ã�Aװ���з�Ӧ�����ӷ���ʽΪ__________________��
(2)Ư�۽���U�ι��в������仯ѧ����ʽ��___________________________________��
(3)Cװ�õ�������____________________��
(4)��ʵ������Ư�۵���Ч�ɷ�ƫ�ͣ���ѧ�����������������Ϸ��֣���Ҫԭ������U�ι��л�������������Ӧ��
���¶Ƚϸ�ʱ��������ʯ�ҷ�Ӧ����Ca(ClO3)2��Ϊ����˸���Ӧ�ķ������ɲ�ȡ�Ĵ�ʩ��____________________��
�����ж���һ������Ӧ_____________________________________(�û�ѧ����ʽ��ʾ)��
���𰸡�MnO2+4H+ + 2Cl- ![]() Mn2+ +Cl2��+2H2O 2Cl2 + 2Ca(OH)2 == Ca(ClO)2 + CaCl2 + 2H2O ���ն�����������ֹ��Ⱦ���� ��Bװ�÷�����ˮ�� 2HCl+Ca(OH)2 == CaCl2 + 2H2O
Mn2+ +Cl2��+2H2O 2Cl2 + 2Ca(OH)2 == Ca(ClO)2 + CaCl2 + 2H2O ���ն�����������ֹ��Ⱦ���� ��Bװ�÷�����ˮ�� 2HCl+Ca(OH)2 == CaCl2 + 2H2O
��������
��1��ʵ���ҿ��ù������������Ũ�����ڼ�����������ȡ��������ѧ����ʽΪMnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O���ݴ�д�����ӷ���ʽ��
MnCl2+Cl2��+2H2O���ݴ�д�����ӷ���ʽ��
��2����������ʯ�ҷ�Ӧ���ɴ�����ơ��Ȼ��ƺ�ˮ���ݴ�д����ѧ����ʽ��
��3��Cװ����ʢ������������Һ���������ն������������ֹ��Ⱦ������
��4�����¶Ƚϸ�ʱ��������ʯ�ҷ�Ӧ����Ca(ClO3)2��Ϊ����˸���Ӧ�ķ�����Ӧ�ý����¶ȣ��ɽ�Bװ�÷�����ˮ�У�
�������ӷ������ȹ��������ɵ������к����Ȼ��⣬�Ȼ��������������Ʒ�Ӧ��
��1��ʵ���ҿ��ù������������Ũ�����ڼ�����������ȡ��������ѧ����ʽΪMnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O�����ӷ���ʽΪMnO2+4H+ + 2Cl-
MnCl2+Cl2��+2H2O�����ӷ���ʽΪMnO2+4H+ + 2Cl-![]() Mn2+ +Cl2��+2H2O��
Mn2+ +Cl2��+2H2O��
�ʴ�Ϊ��MnO2+4H+ + 2Cl-![]() Mn2+ +Cl2��+2H2O��
Mn2+ +Cl2��+2H2O��
��2����������ʯ�ҷ�Ӧ���ɴ�����ơ��Ȼ��ƺ�ˮ���仯ѧ����ʽ��2Cl2 + 2Ca(OH)2 == Ca(ClO)2 + CaCl2 + 2H2O��
�ʴ�Ϊ��2Cl2 + 2Ca(OH)2 == Ca(ClO)2 + CaCl2 + 2H2O��
��3��Cװ����ʢ������������Һ���������ն������������ֹ��Ⱦ��������Cװ�õ�������������������ֹ��Ⱦ������
�ʴ�Ϊ�����ն�����������ֹ��Ⱦ������
(4)���¶Ƚϸ�ʱ��������ʯ�ҷ�Ӧ����Ca(ClO3)2��Ϊ����˸���Ӧ�ķ�����Ӧ�ý����¶ȣ��ɲ�ȡ�Ĵ�ʩ�ǽ�Bװ�÷�����ˮ�У���ֹ�¶ȹ�������Ca(ClO3)2��
�ʴ�Ϊ����Bװ�÷�����ˮ�У�
�������ӷ������ȹ��������ɵ������к����Ȼ��⣬�Ȼ��������������Ʒ�Ӧ��������һ������Ӧ�Ļ�ѧ����ʽ��2HCl+Ca(OH)2 == CaCl2 + 2H2O��
�ʴ�Ϊ��2HCl+Ca(OH)2 == CaCl2 + 2H2O��

 ��ʦ����ɳ���ʱͬ��ѧ����ϵ�д�
��ʦ����ɳ���ʱͬ��ѧ����ϵ�д�����Ŀ����������������������������ͻ���ϢϢ��ء�
(1)NO���ٳ����㱻�ƻ����䷴Ӧ������ͼ��ʾ��
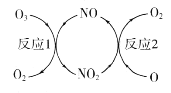
��NO��������________________________��
����֪��O3(g)+O(g) ��2O2(g) ��H=-143kJ��mol-1
��Ӧl��O3(g)+NO(g) ��NO2(g)+O2(g)��H1=-200.2kJ��mol-1
��Ӧ2���Ȼ�ѧ����ʽΪ____________________________��
(2)���쵰��(Mb)�Ǽ����ڴ������ĵ����ʣ����ɼ��쵰�ĸʰ���(H2NCH2COOH)��һ���������ʣ�����Һ��������������ʽ���ڣ���ת����ϵ���� �������ӵ����ʵ�������(��)��[
�������ӵ����ʵ�������(��)��[![]() ]�Ĺ�ϵ��ͼ��ʾ��
]�Ĺ�ϵ��ͼ��ʾ��
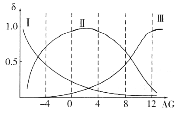
����Һ������ʱ����������Ũ���ɴ�С��˳��Ϊ______________________��
����AG=12����Һ�м������NaOH��Һʱ����Ҫ��Ӧ�����ӷ���ʽΪ______________��
(3)���쵰��(Mb)����O2�������MbO2��![]() ��37��ʱ��ü��쵰�Ľ�϶�(��)��p(O2)�Ĺ�ϵ���±���
��37��ʱ��ü��쵰�Ľ�϶�(��)��p(O2)�Ĺ�ϵ���±���
[��϶�(��)ָ����O2��ϵļ��쵰��ռ�ܼ��쵰�����ʵ�������]
p(O2)��kPa | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
��(MbO2)% | 50.0 | 66.7 | 80.0 | 85.7 | 88.9 | 90.9 | 92.3 |
�ټ���37��ʱ��������Ӧ��ƽ�ⳣ��K=__________kPa-1(�������Һ�е����ʷֱ��÷�ѹ�����ʵ���Ũ�ȱ�ʾ)��
��37��ʱ����������������ѹΪ21.0 kPa��������������ʱ�������ֵΪ________��(����1λС��)��
���¶Ȳ���ʱ���ο���ɽ��ʱ����MbO2��Ũ�ȱ���ɽ��________(����������������)��
���о����֣�v��=k����c(Mb)��p(O


